题目内容
(15分)实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用)。
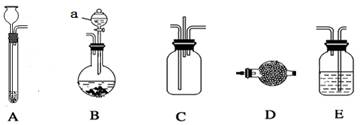
可供选择的液体试剂及固体药品:
请回答下列问题:
(1)装置B中a仪器的名称 。
(2)可由A装置制取相对分子质量小于32的气体有 (任意写2种)。
(3)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→ →C← ← ←B。写出装置B(无需加热)中反应的离子方程式 。
(4)完成上述实验需选用仪器D和E,D中选用( )、E中选用( )(填写序号)
A.无水氯化钙 B.饱和碳酸氢钠溶液 C.饱和食盐水
D.五氧化二磷 E.碱石灰 F.浓硫酸
(5)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式 。
(6)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子

可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、 碱石灰、Cu、Zn、Na2S |
(1)装置B中a仪器的名称 。
(2)可由A装置制取相对分子质量小于32的气体有 (任意写2种)。
(3)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→ →C← ← ←B。写出装置B(无需加热)中反应的离子方程式 。
(4)完成上述实验需选用仪器D和E,D中选用( )、E中选用( )(填写序号)
A.无水氯化钙 B.饱和碳酸氢钠溶液 C.饱和食盐水
D.五氧化二磷 E.碱石灰 F.浓硫酸
(5)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式 。
(6)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子
(1)滴液漏斗(分液漏斗)(2)H2、NH3、NO
(3)D、E、E,2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O (4)E,C、F或F、C
(5)3Cl2+8NH3=6NH4Cl+N2
(6)将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+(或其他合理答案)
(3)D、E、E,2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O (4)E,C、F或F、C
(5)3Cl2+8NH3=6NH4Cl+N2
(6)将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+(或其他合理答案)
试题分析:(1)装置B中a仪器的名称是分液漏斗;(2)A装置适宜块状固体与液体反应制取气体;反应不需要加热;制取的气体在液体中的溶解度不大。用A装置制取相对分子质量小于32的气体有H2、NH3、NO。(3)A制取氨气,然后用盛有碱石灰的干燥管D来干燥氨气;B制取氯气,然后除去杂质HCl气体用盛有饱和食盐水广口瓶E,再用盛有浓硫酸的广口瓶来干燥氯气。最后在C中对气体进行混合。在装置B(无需加热)中制取氯气的反应的离子方程式是2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O; (4)仪器D用于干燥氨气,由于氨气是碱性气体,所以要用碱性干燥剂干燥,用碱石灰,选项是E。装置E首先是除去杂质HCl气体用饱和食盐水,然后干燥气体,由于氯气是酸性气体,所以可以选用酸性干燥剂浓硫酸。因此选项是C、F。(5)根据题意可得方程式:3Cl2+8NH3=6NH4Cl+N2。(6)检验白烟物质是NH4Cl含有的离子是Cl-、NH4+。检验其中的离子的方法是将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+。也可用湿润的红色石蕊试纸,若变为蓝色,就证明含有NH4+。

练习册系列答案
相关题目
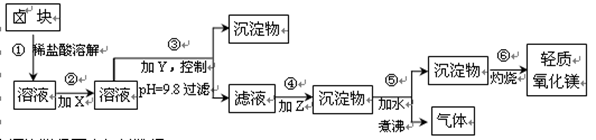
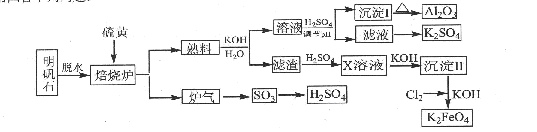
 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .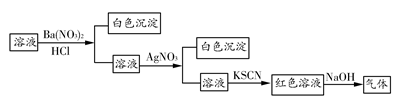
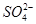
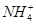
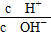 =1×1012,且含有大量Al3+和NO3—,检
=1×1012,且含有大量Al3+和NO3—,检