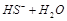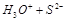题目内容
(14分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有杂质Fe2O3。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示。
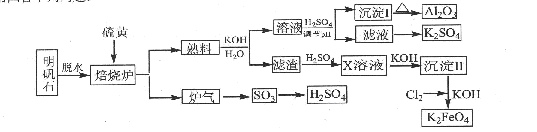
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
(2)生成沉淀I的离子方程式为 ,沉淀II的化学式为 。
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 。
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: 。
(5)从滤液中得到K2SO4晶体的方法是 。
(6) K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的
阳极反应式: .

请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)
 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .(2)生成沉淀I的离子方程式为 ,沉淀II的化学式为 。
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 。
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: 。
(5)从滤液中得到K2SO4晶体的方法是 。
(6) K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的
阳极反应式: .
(每空2分,共14分)
(1)3.612×1024或6NA
(2)AlO2-+H++H2O=Al(OH)3↓ Fe(OH)3
(3)取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
(5)蒸发结晶
(6)Fe+8OH--6e-=FeO42-+4H2O
(1)3.612×1024或6NA
(2)AlO2-+H++H2O=Al(OH)3↓ Fe(OH)3
(3)取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
(5)蒸发结晶
(6)Fe+8OH--6e-=FeO42-+4H2O
试题分析:(1)102gAl2O3的物质的量是1mol,即生成1molAl2O3时也生成3mol的二氧化硫,硫酸根离子中S元素的化合价为+6价,二氧化硫中的S元素的化合价为+4价,所以生成3mol的二氧化硫转移电子的物质的量是6mol,即3.612×1024或6NA;
(2)沉淀I是氢氧化铝沉淀,明矾石经过脱水、焙烧、与氢氧化钾溶液反应后得到的溶液中含有偏铝酸根离子,加入硫酸生成氢氧化铝沉淀,离子方程式为AlO2-+H++H2O=Al(OH)3↓ 沉淀II与氯气、氢氧化钾溶液反应生成高铁酸钾,所以沉淀II的化学式为 Fe(OH)3;
(3)氢氧化铝是偏铝酸钾溶液与硫酸溶液反应的产物,所以氢氧化铝沉淀中可能含有硫酸根离子,证明沉淀是否洗涤干净即证明洗涤液中是否含有硫酸根离子,证明方法是取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)沉淀II与氯气、氢氧化钾溶液反应生成高铁酸钾,铁元素化合价升高,氯元素的化合价降低成为氯离子,化学方程式为2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O;
(5)从硫酸钾溶液中得到硫酸钾晶体的方法是蒸发结晶
(6)以铁为电极,电解浓的KOH溶液来制取K2FeO4,阳极发生氧化反应,K2FeO4中铁元素的化合价为+6价,所以铁失6个电子与氢氧根离子结合生成FeO42-,电极反应式为Fe+8OH--6e-=FeO42-+4H2O。

练习册系列答案
相关题目
 2OH- +Cl2↑ +H2↑
2OH- +Cl2↑ +H2↑