题目内容
常温下,某未知溶液中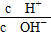 =1×1012,且含有大量Al3+和NO3—,检
=1×1012,且含有大量Al3+和NO3—,检
验此溶液中是否大量存在以下6种离子:①SiO32—、②NH4+、③Fe2+、④Na+、⑤HCO3—、⑥Cl-,其中不必检验就能加以否定的离子是( )
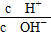 =1×1012,且含有大量Al3+和NO3—,检
=1×1012,且含有大量Al3+和NO3—,检验此溶液中是否大量存在以下6种离子:①SiO32—、②NH4+、③Fe2+、④Na+、⑤HCO3—、⑥Cl-,其中不必检验就能加以否定的离子是( )
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
A
常温下,c(H+)/c(OH-)=1×1012,c(H+)·c(OH-)=1×10-14,联立解得c(H+)=0.1 mol/L,故该溶液呈酸性。又因所给溶液中含有NO3—,故SiO32—、Fe2+、HCO3—不能大量存在。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目