题目内容
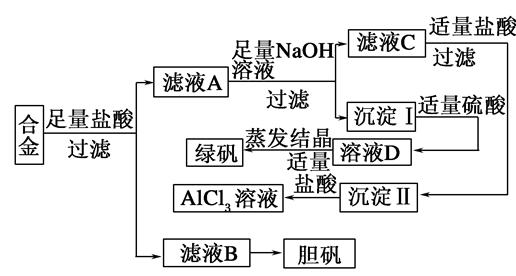
(1)接触法;(1分)离子交换膜电解槽
(2)Fe、稀盐酸
(3)CuCl2+CuSO4+SO2+2H2O="2CuCl↓+2" H2SO4
(4)抽滤或者减压过滤;减少产品CuCl的损失;防止CuCl的水解。
(5)Cu+2 H2SO4(浓) CuSO4+ SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,
CuSO4+ SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,
CuCl2+CuSO4+SO2+2H2O="2CuCl↓+2" H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体。
(6)生产中应防止CuCl的氧化和见光分解
(7)加速样品的溶解,0.95或者95%
解析试题分析:(1)工业上用接触法制硫酸,氯碱工业的装置是离子交换膜电解槽
(2)废液中含有Fe3+、Cu2+所以应加入Fe除去,过量的Fe用稀盐酸除去,所以试剂X、Y分别是Fe、稀盐酸
(3)CuCl被二氧化硫还原氯化铜而得到,化学方程式为CuCl2+CuSO4+SO2+2H2O="2CuCl↓+2" H2SO4
(4)快速过滤应采用抽滤或减压过滤的方法,CuCl微溶于水,不溶于乙醇,所以用无水乙醇洗涤的目的是减少CuCl的损失,调节溶液的pH不能过大的原因是防止CuCl水解
(5)Cu与浓硫酸反应的过程中有二氧化硫生成,且生成的CuSO4和 SO2为1∶1,生产CuCl的过程中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体。
(6)因为CuCl露置于空气中易被氧化为绿色的高价铜盐,见光则分解,变成褐色,这些问题应注意。
(7)玻璃珠的作用是加速样品的溶解,根据题目中所给数据及平行实验结果相差不能超过0.3%,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是23.9ml,所以CuCl的纯度为23.9×10-3L×0.1 mol·L-1×99.5g·mol-1/0.25g×100%=95%
考点:考查CuCl的制备、试剂的选择、书写化学方程式、实验中的问题分析、相应计算等能力

柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。①铁粉的作用是 。
②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
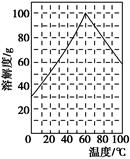
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O晶体。
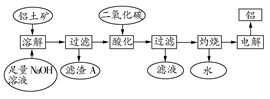
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下: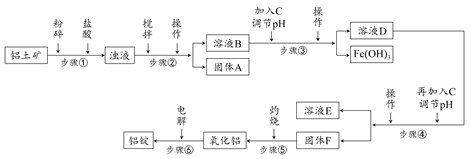
一些氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
| A.高空排放 |
| B.用纯碱溶液吸收制备亚硫酸钠 |
| C.用氨水吸收后,再经氧化制备硫酸铵 |
| D.用BaCl2溶液吸收制备BaSO3 |
A过滤;B加过量NaOH溶液;C蒸发结晶;D灼烧;E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
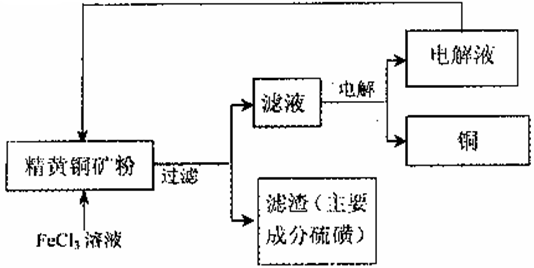
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为 _____________。
(5)该工艺流程中,可以循环利用的物质是_____(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。