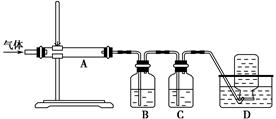
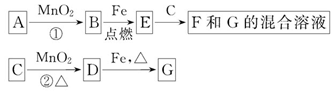
题目内容
科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
(1)稀硫酸和铁粉
(2)杀菌剂(强氧化剂)和吸附剂(净水剂)
(3)Zn+2OH--2e-=Zn(OH)2变小
(4)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-218 kJ/mol
解析

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
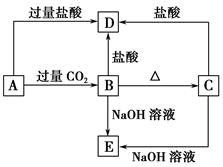
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
| |
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为
0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象


 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O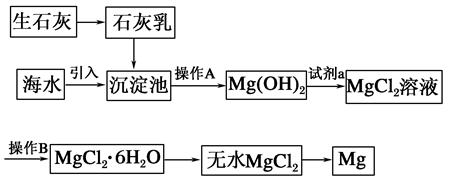
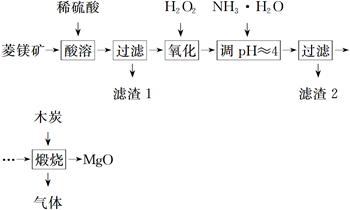
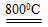 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑