题目内容
【题目】已知A为应用广泛的金属单质、B溶液呈浅绿色、C溶液焰色反应呈紫色、C溶液可使酚酞溶液呈红色,各物质有如图所示的相互转化:
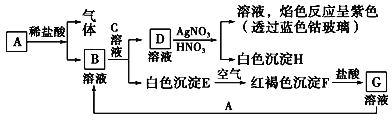
试回答:
(1)写出B的化学式_________________,D的化学式_________________。
(2)写出由E转变成F的化学方程式__________________________________。
(3)写出向G溶液中加入A的离子方程式:____________________________;
【答案】 FeCl2 、KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+
【解析】A为应用广泛的金属单质、B溶液呈浅绿色,则A为铁,B为氯化亚铁;C溶液焰色反应呈紫色、C溶液可使酚酞溶液呈红色,说明C中含有钾元素,且溶液显碱性,则C为氢氧化钾。根据框图,D为氯化钾溶液,E为氢氧化亚铁,F为氢氧化铁,G为氯化铁,H为氯化银。
(1)根据上述分析,B为氯化亚铁,D为氯化钾溶液,故答案为:FeCl2;KCl;
(2)由氢氧化亚铁转变成氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向氯化铁溶液中加入铁粉的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+。

【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为: 
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①中碳酸锶与盐酸反应的离子方程式 .
(2)在步骤②﹣③的过程中,将溶液的pH值由1调节至;宜用的试剂为 .
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是 .
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是 .
A.50~60℃
B.80~100℃
C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是 .
(2)分析白色沉淀产生的原因,甲同学认为是NO3﹣氧化了SO2 , 乙同学认为是溶液中溶解的O2氧化了SO2 .
①支持甲同学观点的实验证据是 .
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式 .
(3)乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mLmol/L溶液(填化学式)中通入SO2 |
(4)探究2:在氧化SO2的过程中,NO3﹣和O2哪种微粒起到了主要作用.
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
|
向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2 , 用pH传感器分别测定溶液pH随时间(t)变化的曲线. |
|
图1,在无氧条件下,BaCl2溶液pH下降的原因是 .
(5)图2,BaCl2溶液中发生反应的离子方程式为 .
(6)依据上述图象你得出的结论是 , 说明理由 .
【题目】分析下列氧化还原反应中化合价变化的关系,氧化剂和氧化产物都正确的是
化学反应方程式 | 氧化剂 | 氧化产物 | |
A | 3Cl2+2Fe | Fe | FeCl3 |
B | 2 Na+2 H2O===2 NaOH+H2↑ | H2O | NaOH |
C | 2HClO | HClO | HClO |
D | Cl2+Na2SO3+H2O =2HCl+Na2SO4 | Cl2 | HCl |
A. A B. B C. C D. D
【题目】下列操作与实验现象不匹配的是( )
反应 | 现象 | |
A | 把明矾溶液滴入含悬浮泥沙的水中 | 产生不溶物 |
B | 在氯气中点燃氢气 | 产生苍白色火焰 |
C | 将氯气通入紫色石蕊溶液 | 溶液最终由紫色变为红色 |
D | 向硅酸钠浓溶液中滴入稀硫酸 | 出现胶状物 |
A. A B. B C. C D. D



