题目内容
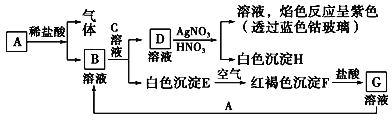
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为: 
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①中碳酸锶与盐酸反应的离子方程式 .
(2)在步骤②﹣③的过程中,将溶液的pH值由1调节至;宜用的试剂为 .
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是 .
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是 .
A.50~60℃
B.80~100℃
C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是
【答案】
(1)SrCO3+2H+=Sr2++CO2↑+H2O
(2)B;E
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
(4)Fe(OH)3、BaSO4
(5)A
(6)饱和氯化锶溶液
【解析】解:以SrCO3为原料制备六水氯化锶(SrCl26H2O),由流程可知,SrCO3和盐酸发生反应:SrCO3+2HCl=SrCl2+CO2↑+H2O,反应后溶液中除含有Sr2+和Cl﹣外,还含有少量Fe2+、Ba2+杂质,加入过氧化氢,将Fe2+氧化为Fe3+ , 然后加硫酸生成硫酸钡沉淀,同时调节溶液pH,使Fe3+转化氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2 , 最后蒸发、冷却结晶得到SrCl26H2O.
(1.)碳酸锶与盐酸反应生成氯化锶、二氧化碳和水,反应的离子方程式为SrCO3+2H+=Sr2++CO2↑+H2O,
故答案为:SrCO3+2H+=Sr2++CO2↑+H2O;
(2.)由表中数据可知,Fe3+在pH=1.5时开始沉淀,在pH=3.7时沉淀完全,故在步骤②﹣③的过程中,将溶液的pH值由1调节至3.7,使Fe3+转化氢氧化铁沉淀,且不能引入新杂质,可以选择氢氧化锶粉末,
故答案为:B;E;
(3.)操作②加入过氧化氢,目的是将Fe2+氧化为Fe3+ , 反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4.)加入了稀硫酸,有硫酸钡生成,加入过氧化氢,将Fe2+氧化为Fe3+ , 再调节溶液pH,水解可生成氢氧化铁沉淀,操作③中所得滤渣的主要成分是BaSO4、Fe(OH)3 ,
故答案为:Fe(OH)3、BaSO4;
(5.)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃,
故答案为:A;
(6.)根据溶解平衡,增大铯离子、氯离子浓度,可以解答氯化铯的溶解,且不引入新杂质,步骤⑥宜选用的无机洗涤剂是:饱和氯化锶溶液,
故答案为:饱和氯化锶溶液.
以SrCO3为原料制备六水氯化锶(SrCl26H2O),由流程可知,SrCO3和盐酸发生反应:SrCO3+2HCl=SrCl2+CO2↑+H2O,反应后溶液中除含有Sr2+和Cl﹣外,还含有少量Fe2+、Ba2+杂质,加入过氧化氢,将Fe2+氧化为Fe3+ , 然后加硫酸生成硫酸钡沉淀,同时调节溶液pH,使Fe3+转化氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2 , 最后蒸发、冷却结晶得到SrCl26H2O.(1)根据反应方程式改写成离子方程式;(2)根据Fe3+开始沉淀pH与沉淀完全pH调节溶液的pH范围,调节溶液pH使Fe3+转化氢氧化铁沉淀,且不能引入新杂质;(3)操作②加入过氧化氢,将Fe2+氧化为Fe3+;(4)SrCO3和盐酸反应后溶液中除含有Sr2+和Cl﹣外,还含有少量Fe2+、Ba2+杂质,加入了稀硫酸,有硫酸钡生成,加入过氧化氢,将Fe2+氧化为Fe3+ , 再调节溶液pH,水解可生成氢氧化铁沉淀;(5)根据六水氯化锶晶体开始失去结晶水的温度选择热风吹干时适宜的温度;(6)根据溶解平衡且不能引入新杂质分析解答.

 名校课堂系列答案
名校课堂系列答案