题目内容
【题目】某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题:

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的_______。
(2)B中的液体为____________,其作用为____________________________________。
(3)A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。
(4)D中NaOH溶液的作用是________________________________________(用离子方程式说明)。
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见:
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色。
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则______(填“甲”或“乙”)的意见正确。
【答案】 丙 浓硫酸 干燥氯气或吸收氯气中的水蒸气 A中有色布条褪色,C中有色布条不褪色 否 Cl2+2OH-===Cl-+ClO-+H2O 乙
【解析】(1)高锰酸钾固体和浓盐酸反应制备氯气,反应不需要加热,为固体与液体反应,且氯气能溶于水,甲装置适用于固体和液体加热制备气体,乙装置适用于固体和液体反应,要求固体难溶于水且生成的气体难溶于水,丙装置适合,故选丙;(2)浓硫酸具有吸水性,且浓硫酸和氯气不反应,所以B中的液体为浓硫酸,作用是干燥氯气;(3)高锰酸钾固体和浓盐酸反应生成的氯气中有水蒸气,进入A中,氯气和水蒸气反应生成盐酸和次氯酸,HClO有漂白性,A中有色布条褪色,B中浓硫酸具有吸水性干燥氯气,干燥氯气不能使有色布条褪色,所以C中有色布条不褪色,A、C的实验现象不能说明氯气具有漂白性;(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2OH-===Cl-+ClO-+H2O;(5)因在褪色后的溶液中逐渐加入足量的NaOH溶液,因溶液中有酚酞,碱性溶液应显红色,溶液一直未见红色,说明氯气溶于水生成漂白性物质,使溶液褪为无色,不是由于碱被中和褪色,故乙正确。
【题型】实验题
【结束】
21
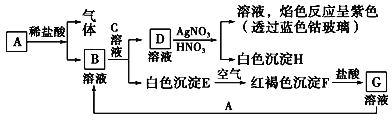
【题目】有一无色溶液100 mL,其中可能含有Fe3+、Al3+、Na+、Mg2+、Cu2+、NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]() 等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。

请回答下列问题:
(1)焰色反应是________(填“物理”或“化学”)变化;实验②中经过滤得到白色沉淀,该沉淀如何洗涤?______________________________________________________________。
(2)原溶液中一定存在的离子有________(写化学式),可能存在的离子有________。
(3)实验③中产生的白色沉淀的成分可能是_________________________________。
(4)若溶液中K+物质的量为0.04 mol,则c(Na+)=________。
【答案】 物理 向过滤装置中加入蒸馏水至浸没沉淀,让水自然滤下,重复操作2~3次 Na+、SO42-、Al3+、Mg2+ K+ Al(OH)3和Mg(OH)2[或Mg(OH)2] 0.6 molL-1
【解析】溶液焰色反应呈黄色,说明溶液中含有Na+离子,溶液呈无色,则一定不含有色离子:Fe3+、Cu2+,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,判断一定无CO32-,图象分析可知,实验中生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,加入过氧化钠产生的是无色无味的气体,可以判定一定没有NH4+,因此溶液中一定含有SO42-、Mg2+、Na+、Al3+,一定不存在NH4+、CO32-、Fe3+、Cu2+,不能判断溶液中是否含有K+。
(1)焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,焰色反应是物理变化,它并未生成新物质;实验②中经过滤得到白色沉淀为硫酸钡沉淀,沉淀洗涤方法是向过滤装置中加入蒸馏水至浸没沉淀,让水自然滤下,重复操作2~3次;(2)原溶液中一定存在的离子有SO42-、Mg2+、Na+、Al3+,可能存在K+;(3)实验③是过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和铝离子生成氢氧化铝沉淀,和镁离子生成氢氧化镁沉淀,反应中产生的白色沉淀的成分可能是Al(OH)3和Mg(OH)2[或Mg(OH)2];(4)依据图形变化可知,Mg2+物质的量为0.1mol,Al3+物质的量为0.1mol,SO42-离子物质的量等于硫酸钡沉淀物质的量=69.9g÷233g/mol=0.3mol,溶液体积为100mL,若溶液中K+物质的量为0.04mol,依据电荷守恒计算c(K+)+c(Na+)+3c(Al3+)+2c(Mg2+)=2c(SO42-),c(Na+)=2×3mol/L-0.4mol/L-3×1mol/L-2×1mol/L=0.6mol/L。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案