题目内容
下列图像与对应叙述相符的是( )
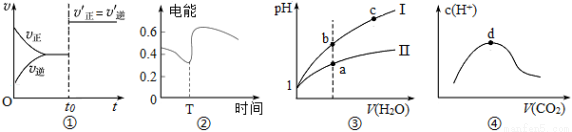
A.图①表示已达平衡的某反应在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
B.图②表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,在T时加入了H2O2
C.图③表示同温度下、同体积pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸
D.图④表示向NaOH溶液中通入CO2,溶液中水电离出的c(H+)变化曲线,则最高点d处溶液中各离子浓度大小为c (Na+)>c(OH-)>c(CO32-)>c(HCO3-) >c(H+)
练习册系列答案
相关题目
为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|


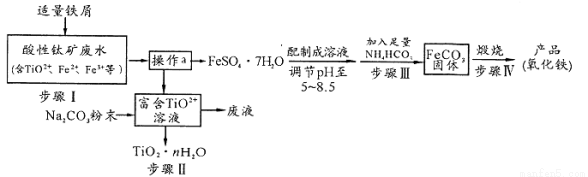
 s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。 。在实际工业生产中,加入沉淀剂BaCl
。在实际工业生产中,加入沉淀剂BaCl 2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 

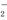 +4I
+4I +4H+==2H2O+2I2+Cl
+4H+==2H2O+2I2+Cl