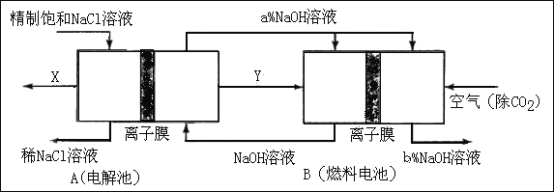
题目内容
【题目】工业上利用绿矾制备还原铁粉的工业流程如下:
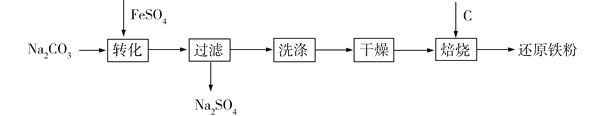
(1)制备FeCO3时,选用的加料方式是_______________(填字母)。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________。
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为________________。
(4)取干燥后的FeCO3样品12.49 g隔绝空气焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为_______________(写出一种即可),计算FeCO3样品中FeCO3与FeOOH的质量_____________(写出计算过程)。
【答案】 c 取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 4(FeCO3·nH2O)+O24FeOOH+4CO2+(4n2)H2O FeO与Fe2O3(或FeO与Fe3O4或FeO、Fe2O3、Fe3O4等) 设样品中FeCO3物质的量为x;FeOOH物质的量为y;依据铁元素守恒得到:x+y=6.16 g/56 g·mol1;质量关系:116 g·mol1×x+89 g·mol1×y=12.49 g,解得x=0.1 mol;y=0.01 mol;得到质量为FeCO3:11.6 g,FeOOH:0.89 g。
【解析】(1)利用Na2CO3溶液和FeSO4溶液反应制备FeCO3,由于Na2CO3溶液碱性较强,可能会生成Fe(OH)2沉淀,如果将Na2CO3加入FeSO4溶液中,Fe2+是过量的,并且FeSO4溶液为酸性,Fe2+不易形成Fe(OH)2沉淀,![]() 容易与Fe2+结合为沉淀析出。因此为避免生成Fe(OH)2沉淀,应将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中。
容易与Fe2+结合为沉淀析出。因此为避免生成Fe(OH)2沉淀,应将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中。
(2)取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,依据氧化还原反应的电子守恒和原子守恒,写出化学方程式为4(FeCO3·nH2O)+O24FeOOH+4CO2+
(4n2)H2O。
(4)样品为FeCO3和FeOOH,依据元素化合价可知铁元素化合价为二价和三价,加热焙烧600℃,质量变为8.00 g,分解生成了铁的氧化物、二氧化碳和水;根据铁元素化合价判断,氧化物中含有亚铁离子和铁离子,氧化物为FeO与Fe2O3或FeO与Fe3O4或FeO、Fe2O3、Fe3O4;设样品中FeCO3物质的量为x;FeOOH物质的量为y;
依据铁元素守恒得到:x+y=6.16 g/56 g·mol1;质量关系:116 g·mol1×x+89 g·mol1×y=12.49 g
计算得到x=0.1 mol;y=0.01 mol;
得到质量为FeCO3:11.6 g,FeOOH:0.89 g。

【题目】硫代硫酸钠俗称保险粉,可用于照相业作定影剂、纸浆漂白作脱氯剂等。实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。本实验对Na2S纯度要求较高,利用项图所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按下图所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,过滤。将所得固体洗涤、干燥,得到Na2S9H2O晶体。
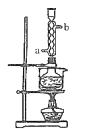
(1)下列说法不正确的是______。
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析岀而损失、去除杂质
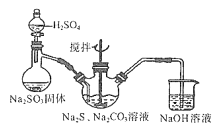
(2)用下图所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是______,三颈烧瓶中发生反应的化学方程式______。
(3)保险粉样品中Na2S2O35H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6,准确称取Wg样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000mol/L碘的标准溶液进行滴定。请回答:
①到达滴定终点的标志______;
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______,产品的纯度为______(设Na2S2O35H2O相对分子质量为M)。

③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的纯度的测量结果______(“偏高”、“偏低”或“不变”)。
(4)某研究小组以硫代硫酸钠与硫酸反应来探究外界条件对反应速率的影响,设计实验如下:
实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
体积/mL | 浓度/mol/L | 体积/mL | 浓度/mol/L | |||
① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
下列有关说法不正确的是______。
A.该同学在实验中采用的研究方法是实验比较法
B.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
C. 实验①和③溶液变浑浊的时间相同
D.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和实验⑤