题目内容
7.把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)═nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol.L-1.min-1.计算:(1)n的值为1
(2)前5min内用X表示的反应速率0.03mol•(L•min)-1
(3)5min末Y的浓度0.15mol/L.
分析 (1)v(Z)=0.01mol•(L•min)-1,以W的浓度变化来表示的反应速率为0.2mol•(L•min)-1,化学计量数与反应速率成正比,据此计算n;
(2)化学反应速率与化学计量数成正比,据此计算出前5min内用X的浓度变化表示的平均反应速率;
(3)根据生成的Z的物质的量计算出消耗的Y的物质的量,再计算出Y的浓度.
解答 解:(1)5min末已生成0.2mol W,则v(W)=$\frac{\frac{0.2}{2}}{5}$=0.02mol•(L•min)-1,则v(Z):v(W)=0.01mol•(L•min)-1:0.02mol•(L•min)-1=1:n,解得n=1,故答案为:1;
(2)5min末生成0.2mol W,则消耗X的物质的量为0.2mol×$\frac{3}{2}$=0.3mol,则前5min内用X的浓度变化表示的平均反应速率为:v(X)=$\frac{\frac{0.3mol}{2L}}{5min}$=0.03mol•(L•min)-1,故答案为:0.03mol•(L•min)-1;
(3)5min末已生成0.2mol W,则反应消耗的Y的物质的量为0.2×$\frac{1}{2}$=0.1mol,则5min末Y的浓度为:c(Y)=$\frac{0.4mol-0.1mol}{2L}$=0.15mol/L,故答案为:0.15mol/L;
点评 本题考查了化学反应速率的计算,题目难度不大,掌握掌握化学反应速率的概念及计算方法,明确反应速率与化学计量数成正比是解答本题的关键.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
20.下列材料中,不属于通常所说的三大合成材料的是( )
| A. | 塑料 | B. | 合成纤维 | C. | 蛋白质 | D. | 合成橡胶 |
18.下列各组物质中,分子数相同的一组是( )
| A. | 2LCO和2LCO2 | B. | 标准状况下22.4LH2O和1mol O2 | ||
| C. | 0,4克H2和4.48L HCl | D. | 18克水和标准状况下22.4L CO2 |
12.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
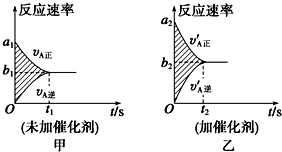
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
①30min时,反应到达平衡状态了吗?是(填“是”或“否”)简述理由从20min到30min时各物质的浓度没有发生改变
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
16.人类的生产生活离不开化学,下列关于生活中的化学知识说法错误的是( )
| A. | 削皮后的苹果应立即吃掉,不能在空气中放置太久 | |
| B. | 明矾溶于水最终可形成的Al(OH)3胶体,能吸附水中悬浮物以净化水 | |
| C. | 可用Na2CO3 治疗胃酸过多 | |
| D. | 不需要通过化学反应就能从海水中获得食盐和淡水 |
 .
.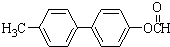 .
.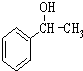 为原料制备
为原料制备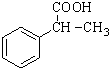 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.