题目内容
【题目】针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的( )
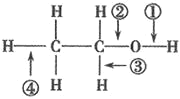
A.与金属钠反应时,①键断裂
B.与浓硫酸共热至170℃时,②、④键断裂
C.在 Ag 催化下与O2反应时,①、③键断裂
D.与醋酸、浓硫酸共热时,②键断裂
【答案】D
【解析】
A.与金属钠反应时,生成乙醇钠和氢气,O-H键断裂,即键①断裂,故A正确;
B.与浓硫酸共热至170℃时,发生消去反应生成乙烯和水,C-O键、与羟基相连的碳的邻碳上的C-H键断裂,即键②和④断裂,故B正确;
C.在 Ag 催化下与O2反应时,生成乙醛和水,H-O键、与羟基相连的碳上的C-H键断裂,即①、③键断裂,故C正确;
D. 与醋酸、浓硫酸共热时,发生酯化反应,醇脱H,O-H键断裂,即键①断裂,故D错误;
综上所述,答案为D。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
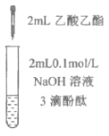
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸