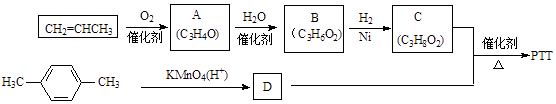
��Ŀ����
����Ŀ��A��B��C��D��E��ԭ������������������ֶ�����Ԫ�أ�B��Eͬ���壬��������������ϼ�+������ϼ�=0��A��C��D��C֮�䶼���γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ�����Խ�������й����⣮
��1����A2C2�����к��еĻ�ѧ������ ��
��2��C��D�γɵĻ�����ĵ���ʽΪ ��
��3��ʵ���ҿ�����B��C��D��ɵĻ�����Ϊ��Ӧ��֮һ��ȡ��A��C��D��ɵĻ������Ӧ�Ļ�ѧ����ʽΪ ��
��4��д��E������A��C��D�γɵĻ������ˮ��Һ��Ӧ�����ӷ���ʽ ��
���𰸡�
��1�����Լ����Ǽ��Լ�
��2��![]()
��3��Na2CO3+Ca��OH��2�TCaCO3��+2NaOH
��4��Si+2OH��+H2O�TSiO32��+2H2��
���������⣺A��B��C��D��E��ԭ������������������ֶ�����Ԫ�أ�B��Eͬ���壬��������������ϼ�+������ϼ�=0����B��E����������Ϊ4��BΪCԪ�أ�EΪSiԪ�أ�A��C��D��C֮�䶼���γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ�����������У�H2O2��H2O��Na2O2��Na2O�ȣ���AΪHԪ�أ�CΪOԪ�أ�DΪNaԪ�أ���1��AΪHԪ�أ�CΪOԪ�أ�DΪNaԪ�أ���A2C2���Ӷ�Ӧ�Ļ�����ΪH2O2 �� Ϊ���ۻ���������мȺ��м��Լ��ֺ��зǼ��Լ������Դ��ǣ����Լ����Ǽ��Լ�����2��C��D�γɵĻ�������Na2O��Na2O2���֣����������ӻ��������ʽ�ֱ�Ϊ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����3����B��C��D��ɵĻ�����ΪNa2CO3 �� ��A��C��D��ɵĻ�����ΪNaOH��NaOH����Na2CO3��Ca��OH��2��Ӧ�Ƶã���Ӧ�Ļ�ѧ����ʽΪNa2CO3+Ca��OH��2�TCaCO3��+2NaOH�����Դ��ǣ�Na2CO3+Ca��OH��2�TCaCO3��+2NaOH����4��Si����NaOH��Һ��Ӧ���ɹ����ƺ���������Ӧ�����ӷ���ʽΪSi+2OH��+H2O�TSiO32��+2H2�������Դ��ǣ�Si+2OH��+H2O�TSiO32��+2H2����
����3����B��C��D��ɵĻ�����ΪNa2CO3 �� ��A��C��D��ɵĻ�����ΪNaOH��NaOH����Na2CO3��Ca��OH��2��Ӧ�Ƶã���Ӧ�Ļ�ѧ����ʽΪNa2CO3+Ca��OH��2�TCaCO3��+2NaOH�����Դ��ǣ�Na2CO3+Ca��OH��2�TCaCO3��+2NaOH����4��Si����NaOH��Һ��Ӧ���ɹ����ƺ���������Ӧ�����ӷ���ʽΪSi+2OH��+H2O�TSiO32��+2H2�������Դ��ǣ�Si+2OH��+H2O�TSiO32��+2H2����

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�