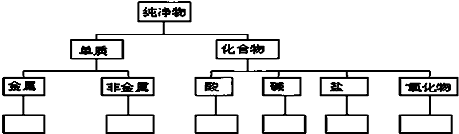
题目内容
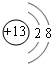
2.已知A、B、C、D是1~18号元素中的四种,0.5molA元素的离子得到6.02×1023个电子被还原为中性原子,0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应,A原子核内质子数与中子数相等.B元素的单质既能与强酸稀溶液反应又能与强碱反应.C得到一个电子后与氩的电子层结构相同,其最高价氧化物的水化物为自然界中最强的酸.D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍.(1)写出B和C两种元素的离子结构示意图
 、
、 .
.(2)A的单质可在D的最高价氧化物中燃烧,试写出其化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)C的最高价氧化物的化学式为Cl2O7;元素A、B、C的单原子离子半径由大到小为Cl->Mg2+>Al3+(用微粒符号).
(4)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是先生成白色沉淀,后白色沉淀部分溶解,将生成物过滤、洗涤、干燥灼烧,可得白色固体质量为0.255g.
分析 短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=$\frac{0.4g}{0.01mol}$=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素的单质既能与强酸稀溶液反应又能与强碱反应,则B为Al;C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素,据此解答.
解答 解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=$\frac{0.4g}{0.01mol}$=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素的单质既能与强酸稀溶液反应又能与强碱反应,则B为Al;C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素.
(1)B和C两种元素的离子分别为Al3+、Cl-,离子结构示意图分别为: 、
、 ,
,
故答案为: 、
、 ;
;
(2)Mg在二氧化碳中燃烧生成MgO与C,其化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)C为Cl元素,最高价氧化物的化学式为Cl2O7;电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径由大到小为Cl->Mg2+>Al3+,
故答案为:Cl2O7;Cl->Mg2+>Al3+;
(4)10mL浓度为1mol/L AlCl3水溶液中n(AlCl3)=0.01L×1mol/l=0.01mol,35mL浓度为1mol/L的苛性钠溶液中n(NaOH)=0.035L×1mol/l=0.035mol,将NaOH溶液滴入氯化铝溶液中,首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝沉淀0.01mol,消耗NaOH0.03mol,剩余NaOH为0.035mol-0.03mol=0.005mol,然后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,0.005molNaOH完全反应消耗0.005mol氢氧化铝,沉淀没有完全溶液,故整个过程现象为:先生成白色沉淀,后白色沉淀部分溶解,
得到氢氧化铝为0.01mol-0.005mol=0.005mol,灼烧生成氧化铝,由Al元素守恒可知,氧化铝的质量为0.005mol×$\frac{1}{2}$×102g/mol=0.255g,
故答案为:先生成白色沉淀,后白色沉淀部分溶解;0.255g.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物知识,(4)中注意根据计算判断.

 名校课堂系列答案
名校课堂系列答案| A. | 氯化氢的电子式为 H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔的结构简式(删:可以)写成 CHCH | |
| C. | 镁的原子结构示意图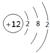 | |
| D. | 碳酸氢钠溶于水电离方程式:NaHCO3═Na++H++CO32- |
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 元素③与⑧的金属性相比:前者强于后者 | |
| B. | 上述8种元素中,元素⑤的最高价氧化物对应的水化物酸性最强 | |
| C. | 元素⑦的气态氢化物与元素④的气态氢化物相比较:前者稳定性强,后者沸点高 | |
| D. | 元素①分别与元素②和⑥形成的化合物所含化学键类型不一定完全相同 |
| A、探究不同催化剂对同一反应速率的影响 | B、探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 | 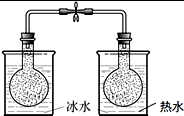 2NO2(g)?N2O4△H<0 试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C、探究醋酸、碳酸、硼酸的酸性强弱 | D、验证外加电流的阴极保护法 |
 试剂:0.1mol/L醋酸溶液、饱和硼酸 溶液0.1mol/L Na2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 | 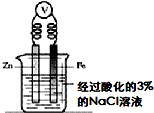 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2、CH4都属于极性键的非极性分子 | |
| B. | C、N、O、F 电负性依次减小 | |
| C. | 基态铜(Cu)原子的电子排布式为[Ar]3d94s2 | |
| D. | 价电子构型为3s23p4的粒子其电子排布图为: |
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
| A. | CH3OH 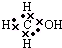 | B. | HClO 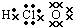 | C. | N2 | D. | OH- |