题目内容
(12分)根据要求回答相关问题:
(1) 除去下列物质中所混有的少量杂质(括号内为杂质),写出有关的反应方程式。
①铜粉 (铝粉) ;
②FeCl3溶液(FeCl2 ) ;
③N2 (O2) ____________________________________________________。
(2)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
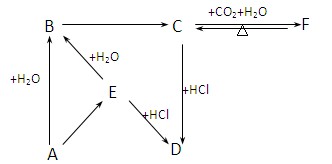
①写出A→B的化学方程式,标出电子转移的方向和数目;
____________________________________________________________
②在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是 。
(1) 除去下列物质中所混有的少量杂质(括号内为杂质),写出有关的反应方程式。
①铜粉 (铝粉) ;
②FeCl3溶液(FeCl2 ) ;
③N2 (O2) ____________________________________________________。
(2)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:

①写出A→B的化学方程式,标出电子转移的方向和数目;
____________________________________________________________
②在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是 。
(1) ①2Al + 2H2O + 2OH- = AlO2- + 3H2 ↑或 2Al + 6H+ ="=" 2Al3+ + 3H2↑
② 2FeCl2 + Cl2 ="=3" FeCl3 ③ 2Cu + O2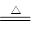 2CuO
2CuO
(2) ;可能是NaOH ,因CO2量少,NaOH过量;可能是NaHCO3,因CO2过量,Na2CO3转化为NaHCO3
② 2FeCl2 + Cl2 ="=3" FeCl3 ③ 2Cu + O2
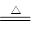 2CuO
2CuO (2) ;可能是NaOH ,因CO2量少,NaOH过量;可能是NaHCO3,因CO2过量,Na2CO3转化为NaHCO3
(1)①铝能溶于氢氧化钠溶液和盐酸中,而铜不能,据此可以除去铝,方程式为2Al + 2H2O + 2OH- = AlO2- + 3H2 ↑或 2Al + 6H+ ="=" 2Al3+ + 3H2↑。
②氯化亚铁具有还原性,能被氯气氧化生成氯化铁,所以除去氯化铁中的氯化亚铁,可以氯气,方程式为2FeCl2 + Cl2 ="=3" FeCl3。
③氧气能和铜反应,但氮气不能,所以要除去氮气中的氧气,可以通过加热的铜,方程式为2Cu + O2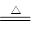 2CuO 。
2CuO 。
(2)E为淡黄色粉末,且含有钠元素,所以E是过氧化钠。则A是钠,B是氢氧化钠,C是碳酸钠,F是碳酸氢钠,D是氯化钠。
①钠和水的反应中,钠失去电子,作还原剂,水是氧化剂得到电子,方程式为。
②CO2和氢氧化钠反应中,如果氢氧化钠过量则生成物碳酸钠中会混有氢氧化钠;如果CO2过量,则部分碳酸钠能和CO2反应生成碳酸氢钠,所以杂质可能是碳酸氢钠。
②氯化亚铁具有还原性,能被氯气氧化生成氯化铁,所以除去氯化铁中的氯化亚铁,可以氯气,方程式为2FeCl2 + Cl2 ="=3" FeCl3。
③氧气能和铜反应,但氮气不能,所以要除去氮气中的氧气,可以通过加热的铜,方程式为2Cu + O2
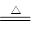 2CuO 。
2CuO 。(2)E为淡黄色粉末,且含有钠元素,所以E是过氧化钠。则A是钠,B是氢氧化钠,C是碳酸钠,F是碳酸氢钠,D是氯化钠。
①钠和水的反应中,钠失去电子,作还原剂,水是氧化剂得到电子,方程式为。
②CO2和氢氧化钠反应中,如果氢氧化钠过量则生成物碳酸钠中会混有氢氧化钠;如果CO2过量,则部分碳酸钠能和CO2反应生成碳酸氢钠,所以杂质可能是碳酸氢钠。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目





