题目内容
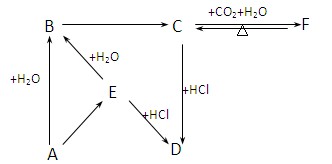
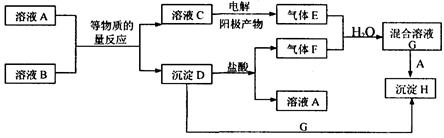
(10分)在下图所示的物质转化关系中(反应条件已略去)。A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质。反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液。

请回答下列问题:
(1)E的化学式为__________。
(2)C的电子式为__________。
(3)F元素在元素周期表中的位置是__________。
(4)反应③的离子方程式为__________。
(5)反应④的化学方程式为__________。
(6)若G具有磁性,则反应②中每生成1mol H转移电子的数目为__________。

请回答下列问题:
(1)E的化学式为__________。
(2)C的电子式为__________。
(3)F元素在元素周期表中的位置是__________。
(4)反应③的离子方程式为__________。
(5)反应④的化学方程式为__________。
(6)若G具有磁性,则反应②中每生成1mol H转移电子的数目为__________。
(1)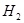 (1分) (2)
(1分) (2)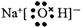 (1分)
(1分)
(3)第3周期,ⅢA族(2分) (4)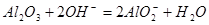 (2分)
(2分)
(5)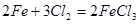 (2分) (6)
(2分) (6)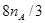 或
或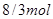 (2分)
(2分)
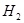 (1分) (2)
(1分) (2)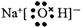 (1分)
(1分)(3)第3周期,ⅢA族(2分) (4)
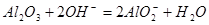 (2分)
(2分)(5)
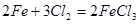 (2分) (6)
(2分) (6)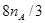 或
或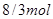 (2分)
(2分)本题属于无机框图题,关键是找准突破点。A是海水中含量最多的盐,则A是氯化钠。工业上用C与D反应制备漂白液,所以C是氢氧化钠,D是氯气。B是最常见的无色液体,因此B是水,则E是氢气。反应②常用于钢轨的焊接,所以F是铝,G是铁的氧化物,H是铁,K是氯化铁,I是氧化铝,J是偏铝酸钠。
(1)E是H2.。
(2)氢氧化钠是含有离子键和极性键的离子化合物,电子式为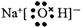 。
。
(3)铝的原子序数是13,所以位于第三周期第ⅢA。
(4)氧化铝是两性氧化物,能溶于氢氧化钠中,方程式为Al2O3+2OH-=2AlO2-+H2O。
(5)氯气具有氧化性,和铁反应生成氯化铁,方程式为2Fe+3Cl2=2FeCl3。
(6)若G具有磁性,则G是四氧化三铁,其中铁的化合价是+8/3,所以反应②中每生成1mol H转移电子是8/3mol,起数目是8/3NA。
(1)E是H2.。
(2)氢氧化钠是含有离子键和极性键的离子化合物,电子式为
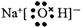 。
。(3)铝的原子序数是13,所以位于第三周期第ⅢA。
(4)氧化铝是两性氧化物,能溶于氢氧化钠中,方程式为Al2O3+2OH-=2AlO2-+H2O。
(5)氯气具有氧化性,和铁反应生成氯化铁,方程式为2Fe+3Cl2=2FeCl3。
(6)若G具有磁性,则G是四氧化三铁,其中铁的化合价是+8/3,所以反应②中每生成1mol H转移电子是8/3mol,起数目是8/3NA。

练习册系列答案
相关题目



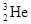 可以作为核聚变材料,下列关于
可以作为核聚变材料,下列关于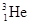 互为同位素
互为同位素