题目内容
18.下列推论正确的是( )| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2═SO2(g)△H2,则△H1>△H2 | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1,则金刚石比石墨稳定 | |
| C. | OH-(aq)+H+(aq)=H2O(l)△H=-57.4kJ•mol-1,则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,则碳的燃烧热大于110.5kJ•mol-1 |
分析 A.固体硫燃烧时要先变为气态硫,过程吸热,据此确定反应热的大小;
B.物质的能量越高越不稳定;
C.反应过程中,稀醋酸电离要吸热;
D.1mol可燃物完全燃烧生成稳定的氧化物放出的热量为燃烧热.
解答 解:A.固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H1<△H2;故A错误;
B.C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石的能量比石墨高,则石墨比金刚石稳定,故B错误;
C.OH-(aq)+H+(aq)=H2O(l)△H=-57.4kJ•mol-1,但由于稀醋酸电离要吸热,所以含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量小于28.7kJ,故C错误;
D.2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,该反应方程式中C的物质的量为2mol,生成的氧化物为CO不是稳定氧化物,还会继续燃烧放热,所以碳的燃烧热大于110.5kJ•mol-1,故D正确.
故选D.
点评 本题考查了反应热大小比较、中和热、燃烧热等,侧重于基础知识的考查,题目难度不大,注意把握燃烧热和中和热的概念.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 凡可燃性气体点燃时都要先检验纯度 | |
| B. | 某物质在空气中燃烧生成二氧化碳和水,该物质一定为甲烷 | |
| C. | 沼气、天然气、煤气的主要成份都是甲烷 | |
| D. | 甲烷和氢气一样也是一种最理想的气体燃料 |
9.某种酒精与水的混合物中,酒精分子与水分子的个数比为5:6,则该混合物中酒精(化学式C2H6O)的质量分数为( )
| A. | 45.5% | B. | 68.0% | C. | 75.4% | D. | 无法计算 |
6.学习化学的目的是运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题.下列说法中你认为不正确的是( )
| A. | 搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度 | |
| B. | 天气闷热时,鱼塘的鱼会接近水面游动,原因是温度高压强小,氧气的溶解度小 | |
| C. | 夏天,铜制眼镜架表面出现的绿色物质[主要成分 Cu2(OH)2CO3],可用稀盐酸除去 | |
| D. | 敞口放置的酒精没有燃烧的原因是温度没有达到酒精的着火点 |
10.下列物质的体积最大的是( )
| A. | 标况下,1mol的NH3 | B. | 4℃时,18克水 | ||
| C. | 2mol的Al(密度为2.7g•cm-3) | D. | 常温常压下1mol的CO2气体 |
7.已知0.1mol/L乙二酸溶液的pH大于1,取等体积的乙二酸溶液与NaOH溶液混合,测得溶液的pH=7,则乙二酸与NaOH物质的量浓度的比值( )
| A. | 小于$\frac{1}{2}$ | B. | 大于$\frac{1}{2}$,小于1 | C. | 等于$\frac{1}{2}$ | D. | 大于1,小于2 |

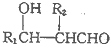 (R1、R2为烃基或H)
(R1、R2为烃基或H)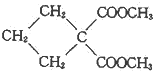 +HBr+HCl
+HBr+HCl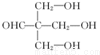 .
. .
. .
. .
.