题目内容
【题目】(1)研究有机物的方法有很多,常用的有①核磁共振氢谱②蒸馏③重结晶④萃取⑤红外光谱⑥过滤,其中用于分子结构确定的有____(填序号)。
(2)下列物质中,其核磁共振氢谱中只有一个吸收峰的是____(填字母)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(3)某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。如图是该有机物的质谱图,则其相对分子质量为______,分子式为________。
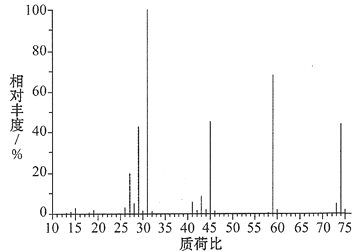
【答案】①⑤ADC4H10O74C4H10O
【解析】
(1)在上述各种研究方法中,蒸馏、重结晶、萃取、过滤是有机物分离或提纯的方法,核磁共振氢谱、红外光谱常用于分子结构确定,答案选①⑤;
(2)其核磁共振氢谱中只有一个吸收峰,说明有机物分子中只有一类氢原子,则
A.CH3CH3分子中只有一类氢原子,A正确;
B.CH3COOH分子中含有两类氢原子,B错误;
C.CH3COOCH3分子中含有两类氢原子,C错误;
D.CH3OCH3分子中只有一类氢原子,D正确;
答案选AD。
(3)碳的质量分数是64.86%,氢的质量分数是13.51%,因此氧元素质量分数是21.63%,则该物质中碳、氢、氧原子个数之比为![]() ,所以其实验式为C4H10O;根据质谱图知,其相对分子质量是74,结合其实验式知其分子式为C4H10O。
,所以其实验式为C4H10O;根据质谱图知,其相对分子质量是74,结合其实验式知其分子式为C4H10O。

 阅读快车系列答案
阅读快车系列答案【题目】NO、NO2等氮氧化物的消除和再利用有多种方法。
(1)活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+ CO2(g) △H = Q kJ·mol-1,在T℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.30 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
①0~10min内,N2的平均反应速率v(N2)= ___________ .
②30min后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是 ____ (填序号).
a.加入一定量的活性炭 b.改变反应体系的温度
c.缩小容器的体积 d.通入一定量的NO e.使用催化剂
(2)NH3催化还原法:原理如图所示。

①若烟气中c(NO2) :c(NO)=1 :1,发生图甲所示的脱氮反应时,每转移1.5mol电子放出的热量为113.8kJ,则发生该脱氮反应的热化学方程式为__________________.
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____________;使用Mn作催化剂时,脱氮率b-a 段呈现如图变化的可能原因是__________(答1点).
(3)直接电解吸收法:先用6%的稀硝酸吸收NOx,生成HNO2(弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,则阳极的电极反应式为________________.
(4)NO2与N2O4之间存在转化:N2O4(g) 2NO2(g),将一定量的N2O4放入恒容密闭容器中。
①己知N2O4的起始压强p0为108 kPa,325℃时,N2O4的平衡转化率为40%,则该温度下反应的平衡常数为:Kp=________kPa(用平衡分压代替平衡浓度计算,分压=总压×各物质的量分数,保留一位小数).
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-压强关系如图所示,在图标出的点中,能表示反应达到平衡状态的点为______。









