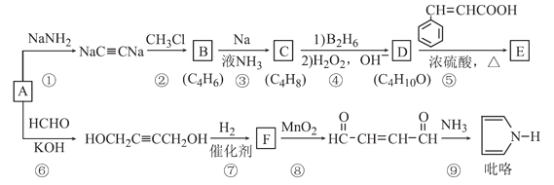
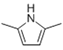
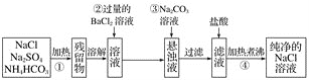
题目内容
【题目】80℃时,2 L密闭容器中充入0.40 mol N2O4,发生如下反应:N2O4(g)![]() 2NO2(g)。一段时间后达到平衡,测得数据如下:
2NO2(g)。一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/( mol·L1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
请回答:
(1)20 s内,v(NO2) =_________mol/(L·s) 1。
(2)升高温度时,c(NO2)增大,则正反应是______(选填“放热”或“吸热”)反应。
(3)该温度下反应的化学平衡常数数值为______。
(4)该条件下N2O4的平衡转化率是______。
【答案】 0.006(或6×10-3) 吸热 1.8 75%(或0.75、或3/4)
【解析】(1)20s内生成NO2的浓度是0.12mol/L,则v(NO2)=0.12mol/L÷20s=0.006mol/(L·s) 1。(2)升高温度时,c(NO2)增大,说明平衡向正反应方向进行,则正反应是吸热反应。(3)平衡时NO2的浓度是0.30mol/L,消耗N2O4是0.15mol/L,所以平衡时N2O4的浓度是0.4mol÷2L-0.15mol/L=0.05mol/L,因此该温度下反应的化学平衡常数数值为![]() 。(4)该条件下N2O4的平衡转化率是
。(4)该条件下N2O4的平衡转化率是![]() 。
。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目