题目内容
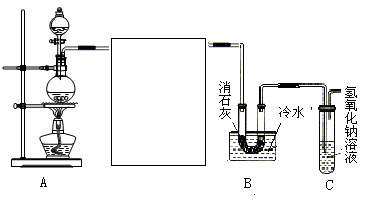
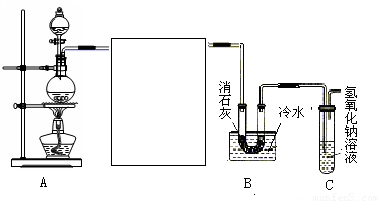
(10分)某化学兴趣小组利用浓盐酸、二氧化锰共热制氯气,并用氯气和消石灰制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应。试回答以下问题: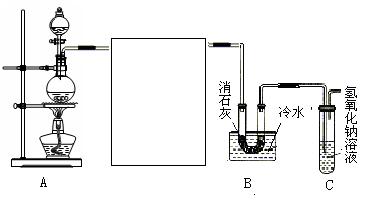
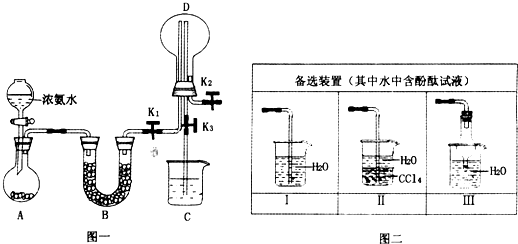
(1)制取氯气时在烧瓶中加入一定量的二氧化锰,通过 (填仪器名称)向烧瓶中加入适量的浓盐酸,写出该反应的离子方程式 。
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。如果A产生的气体直接进入B中,实验产生的不良后果是 。
(3)实验室若用16 mol·L-1的盐酸100 mL与足量的二氧化锰反应,理论上最终生成的Ca(ClO)2的物质的量最多不超过 mol。
(1)分液漏斗,MnO2 + 4H+ + 2Cl-(浓) Mn2+ + Cl2↑+ 2H2O
Mn2+ + Cl2↑+ 2H2O
(2)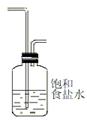 HCl会与Ca(OH)2和Ca(ClO) 2反应,影响产品质量。
HCl会与Ca(OH)2和Ca(ClO) 2反应,影响产品质量。
(3)0.2 mol
解析

练习册系列答案
相关题目