题目内容
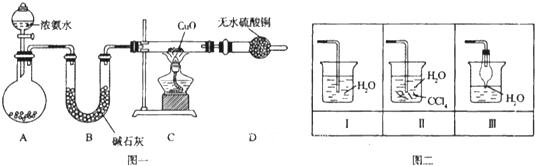
某化学兴趣小组利用图一装置制取氨气并探究氨气的有关性质.
(1)装置A中烧瓶内试剂可选用
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱
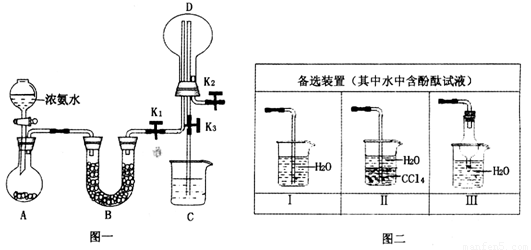
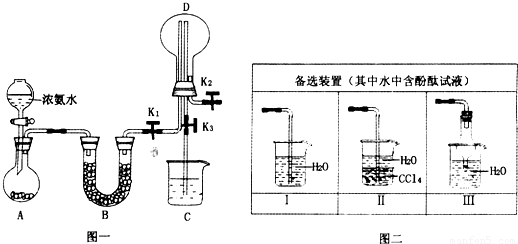
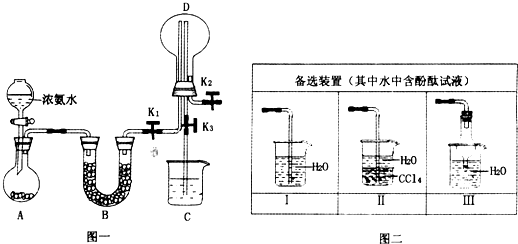
(2)若探究氨气的溶解性,需在K2的导管末端连接图二装置中的
(3)若探究氨气的还原性,需打开K1、K2,K3处导管连接制取纯净、干燥氯气的装置.
①用二氧化锰与浓盐酸制取氯气,生成气体必须通过盛有
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为
③从K3处导管逸出的气体中含有少量Cl2,则C装置中应盛放

(1)装置A中烧瓶内试剂可选用
ace
ace
(填序号)a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱
(2)若探究氨气的溶解性,需在K2的导管末端连接图二装置中的
Ⅱ或Ⅲ
Ⅱ或Ⅲ
装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是用热毛巾将烧瓶捂热
用热毛巾将烧瓶捂热
.(3)若探究氨气的还原性,需打开K1、K2,K3处导管连接制取纯净、干燥氯气的装置.
①用二氧化锰与浓盐酸制取氯气,生成气体必须通过盛有
饱和食盐水,浓硫酸
饱和食盐水,浓硫酸
试剂的洗气瓶;②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为
3Cl2+8NH3=6NH4Cl+N2
3Cl2+8NH3=6NH4Cl+N2
;③从K3处导管逸出的气体中含有少量Cl2,则C装置中应盛放
NaOH
NaOH
溶液(填化学式),反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.分析:(1)氨水易挥发,升高温度能促进氨水分解生成氨气,为促进氨水分解,则烧瓶中加入的物质遇氨水后能放出大量热,且和氨水不反应;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置;利用压强差将烧杯中的水排到烧瓶中;
(3)①浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入烧瓶前,应该用饱和食盐水和浓硫酸除去氯化氢和水蒸气;
②根据氧化还原反应知,生成的无色无味的气体是氮气,根据反应物和生成物写出反应方程式;
③氯气的水溶液呈酸性,所以可以用碱除去氯气.
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置;利用压强差将烧杯中的水排到烧瓶中;
(3)①浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入烧瓶前,应该用饱和食盐水和浓硫酸除去氯化氢和水蒸气;
②根据氧化还原反应知,生成的无色无味的气体是氮气,根据反应物和生成物写出反应方程式;
③氯气的水溶液呈酸性,所以可以用碱除去氯气.
解答:解:(1)氨水易挥发,升高温度能促进氨水分解生成氨气,为促进氨水分解,则烧瓶中加入的物质遇氨水后能放出大量热,且和氨水不反应,
a.碱石灰遇水放出大量热,能使氨水温度升高,且和氨水不反应,故选;
b.浓硫酸和氨水反应,故不选;
c.生石灰和水反应但和氨水不反应,且放出大量热,能使氨水温度升高,促进氨水分解,故选;
d.五氧化二磷能和氨水反应,故不选;
e.烧碱溶解过程中放出大量热,能使氨水温度升高,且和氨水不反应,故选;
故选ace;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置,Ⅱ、Ⅲ装置中都有缓冲装置,Ⅰ没有缓冲装置能产生倒吸,故选Ⅱ或Ⅲ;利用压强差将烧杯中的水排到烧瓶中,操作为用热毛巾将烧瓶捂热,烧瓶中的空气进入烧杯中,导致大气压强大于烧瓶中气体压强,从而使烧杯中的水通过导管进入烧瓶中产生喷泉实验,
故答案为:Ⅱ或Ⅲ;用热毛巾将烧瓶捂热;
(3)①浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入烧瓶前,应该用饱和食盐水和浓硫酸除去氯化氢和水蒸气,故答案为:饱和食盐水,浓硫酸;
②根据氧化还原反应知,生成的无色无味的气体是氮气,所以其反应方程式为:3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
③氯气和水反应生成盐酸和次氯酸导致氯气的水溶液呈酸性,所以可以用氢氧化钠溶液除去氯气,反应离子方程式为:
Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:NaOH,Cl2+2OH-=Cl-+ClO-+H2O.
a.碱石灰遇水放出大量热,能使氨水温度升高,且和氨水不反应,故选;
b.浓硫酸和氨水反应,故不选;
c.生石灰和水反应但和氨水不反应,且放出大量热,能使氨水温度升高,促进氨水分解,故选;
d.五氧化二磷能和氨水反应,故不选;
e.烧碱溶解过程中放出大量热,能使氨水温度升高,且和氨水不反应,故选;
故选ace;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置,Ⅱ、Ⅲ装置中都有缓冲装置,Ⅰ没有缓冲装置能产生倒吸,故选Ⅱ或Ⅲ;利用压强差将烧杯中的水排到烧瓶中,操作为用热毛巾将烧瓶捂热,烧瓶中的空气进入烧杯中,导致大气压强大于烧瓶中气体压强,从而使烧杯中的水通过导管进入烧瓶中产生喷泉实验,
故答案为:Ⅱ或Ⅲ;用热毛巾将烧瓶捂热;
(3)①浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入烧瓶前,应该用饱和食盐水和浓硫酸除去氯化氢和水蒸气,故答案为:饱和食盐水,浓硫酸;
②根据氧化还原反应知,生成的无色无味的气体是氮气,所以其反应方程式为:3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
③氯气和水反应生成盐酸和次氯酸导致氯气的水溶液呈酸性,所以可以用氢氧化钠溶液除去氯气,反应离子方程式为:
Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:NaOH,Cl2+2OH-=Cl-+ClO-+H2O.
点评:本题以实验设计为载体考查了元素化合物的性质,明确氨气的尾气处理中,为防止倒吸现象,可以采用哪些方法.

练习册系列答案
相关题目