题目内容
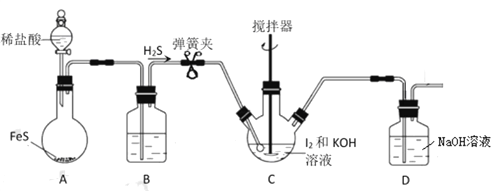
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
A. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
B. 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
D. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
【答案】A
【解析】试题A.浓硫酸与Na2SO3固体反应生成SO2,SO2遇到C中石蕊试液,只变红,不会褪色,因为SO2不能漂白石蕊试液,A项错误;B.醋酸与贝壳中CaCO3反应生成CO2,CO2遇到C中澄清石灰水发生反应CO2+Ca(OH)2=CaCO3↓+H2O,溶液变浑浊,B项正确;C.浓盐酸和MnO2只有在加热条件下才反应生成Cl2,而反应装置中无加热装置,所以C中溶液不褪色,C项正确;D.A为浓氨水,B为生石灰,会生成氨气遇氯化铝生成氢氧化铝白色沉淀,D项正确;答案选A。

练习册系列答案
相关题目