题目内容
【题目】Cl2、Br2和I2都具有氧化性,其氧化性![]() ,Cl2能把溴从溴化物中置换出来,其余依次类推。向
,Cl2能把溴从溴化物中置换出来,其余依次类推。向![]() 、
、![]() 的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
A.NaClB.NaCl、NaBr
C.NaCl、NaBr、NaID.NaCl、NaI
【答案】D
【解析】
Cl2、Br2、I2都具有氧化性,其氧化性由强到弱顺序为:Cl2>Br2>I2,还原性由弱到强为Cl-<Br-<I-,根据氧化还原反应的先后规律知:向含有NaBr和NaI的混合溶液中通入一定量氯气先发生反应:2NaI+Cl2=2NaCl+I2,后发生反应:2NaBr+Cl2=2NaCl+Br2,将溶液蒸干并充分灼烧,溴易挥发,碘易升华,据此分析作答。
A、当氯气过量时,上述两个反应都发生,加热过程中,溴挥发,碘升华,所以剩余固体是氯化钠,不选;
B、当氯气少量时,使NaI全部反应,NaBr部分反应时,加热过程中,碘升华,剩余固体是氯化钠和溴化钠,不选;
C、当氯气少量时,只有部分NaI反应,加热过程中,碘升华,剩余固体是氯化钠和溴化钠、碘化钠,不选;
D、当通入氯气后,氯气先和碘离子反应,后和溴离子反应,所以固体是中不可能是氯化钠和碘化钠;
故选D。

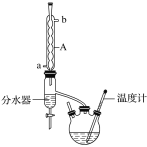
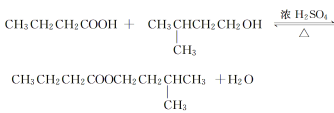
【题目】丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
相对分子质量 | 密度(g·cm-3) | 沸点(℃) | 水中溶解性 | |
正丁酸 | 88 | 0.958 7 | 163.5 | 溶 |
异戊醇 | 88 | 0.813 2 | 131 | 微溶 |
丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇、0.1 mol正丁酸、数滴浓硫酸、5 mL苯和2~3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g。
回答下列问题:
(1)图中A仪器的名称是___________。
(2)在该实验中,三颈烧瓶的容积最适合的是_____(填字母)。
A.50mL B.100mL C.200mL
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____(填字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)分离提纯过程中加入无水硫酸镁的目的是______________。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是_______(填字母)。

(6)本实验的产率是______(保留三位有效数字)。
【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____
