题目内容
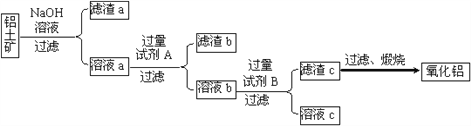
【题目】将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量( n )与反应时间( t )的变化示意图如图所示。 下列说法正确的是( )
A. 苛性钾溶液中KOH的物质的量为0.18mol
B. 反应中转移电子的物质的量是0.09 mol
C. 在酸性条件下ClO- 和ClO3-能反应得到氯气
D. ClO3-的生成可能是由于温度升高引起的
【答案】D
【解析】A.根据电子转移守恒可知n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,故A错误;B.氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图像知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B错误;C.ClO-中Cl元素的化合价是+1价,ClO3-中Cl元素的化合价是+5价,因此两者反应不可能生成Cl2,故C错误;D.根据图像知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;故选D。

【题目】表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置.用化学符号回答下列各问题.
主族 | ||||||||
周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,第一电离能最大的是;电负性最小的金属是 .
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是 .
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是: .
(4)①和⑨的最高价氧化物对应水化物的化学式为和 . ①和⑨两元素形成化合物的化学式为;该化合物灼烧时的焰色为色;该化合物的溶液与元素⑧的单质反应的化学方程式为 .
(5)①和⑤最高价氧化物对应水化物相互反应的化学方程式为;离子方程式为 .
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程 .