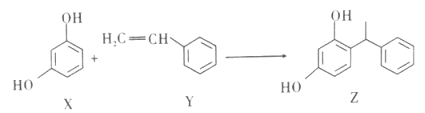
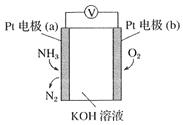
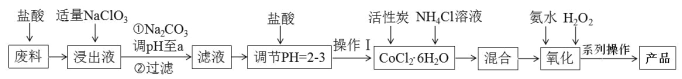
题目内容
【题目】下列说法正确的是( )
A. 1 mol H2O含有的质子数为10 mol
B. 0.5 mol SO42-含8 mol电子
C. 18 g水中含有的氧原子数为6.02×1022
D. 1 mol NaHSO4固体中含有的阴阳离子总数为3×6.02×1023
【答案】A
【解析】
A. 1个H2O中含有10个质子,因此1molH2O中含有10mol质子,故A正确;
B.一个SO42-离子含有50个电子,0.5molSO42-含有的电子数为25mol,故B错误;
C.18g水中含有1mol氧原子,因此含有的氧原子数为![]() ,故C错误;
,故C错误;
D. NaHSO4固体中含有Na+和HSO4-,则1molNaHSO4固体中含有的阴阳离子总数为![]() ,故D错误;
,故D错误;
故答案为:A。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
【题目】读下列药品标签,有关分析不正确的是( )
选项 | A | B | C | D |
物品标签 | 饱和氯水1.01×105 Pa,20 ℃ | 药品:×××
| 碳酸氢钠NaHCO3俗名小苏打(84 g·mol-1) | 浓硫酸H2SO4 密度1.84 g·mL-1浓度98.0% |
分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该药品标签上还标有
|
A. AB. BC. CD. D