题目内容
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因_______________________。
(2)学生丙另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法?____________________。
(Ⅱ)学生丁设计了下图装置以验证氮、碳、硅元素的非金属性强弱。他设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是不溶于水的块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
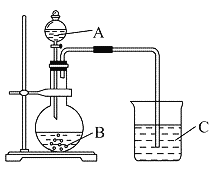
(1)写出所选用物质的化学式: B:_______________。
(2)写出烧杯中发生反应的离子方程式:_______________。
(3)该实验有何不足之处?______________________
【答案】 未除去镁表面的氧化膜 取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH)3,溶解,而Mg(OH)2则不溶。 CaCO3 CO2+SiO32-+H2O=H2SiO3↓+CO32- 或:2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3- 未除去CO2气体中的硝酸气体
【解析】(Ⅰ)(1)根据生成气体的剧烈程度判断金属性强弱,镁条表面有氧化镁,未除去镁表面的氧化膜,反应现象不明显,故答案为:未除去镁表面的氧化膜;
(2)根据氢氧化镁、氢氧化铝是否溶于强碱设计,具体方法:取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH)3溶解,而Mg(OH)2则不溶,故答案为:取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH)3溶解,而Mg(OH)2则不溶;
(Ⅱ)根据题目信息可知,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,方案利用强酸和弱酸盐反应制取弱酸,根据酸性强弱判断金属性强弱。
(1)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,故答案为:CaCO3;
(2)硝酸与碳酸钙反应生成硝酸钙与二氧化碳、水,硅酸钠溶液中通入二氧化碳生成硅酸与碳酸钠,反应的离子方程式为:CaCO3+2H+═Ca2++2CO2↑+H2O、CO2+SiO32-+H2O═H2SiO3↓+CO32-,故答案为:CaCO3+2H+═Ca2++2CO2↑+H2O、CO2+SiO32-+H2O═H2SiO3↓+CO32-;
(3)硝酸易挥发,也能使硅酸钠溶液中生成硅酸沉淀,因此需要除去CO2气体中的硝酸气体,故答案为:未除去CO2气体中的硝酸气体。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的2/3 |
Z | 第3周期原子半径最小的金属 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W
B. 非金属性:Y < W;离子半径:Z > W
C. W在空气中充分燃烧所得产物,可用于杀菌消毒
D. 金属Z与少量NaOH溶液反应,生成两性氢氧化物