题目内容
某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )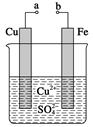
| A.a和b用导线连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为2H++2e-=H2↑ |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极 |
C
解析

练习册系列答案
相关题目
如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是( )。
| A.X是正极,Y是负极 | B.X是负极,Y是正极 |
| C.CuSO4溶液的浓度逐渐减小 | D.CuSO4溶液的pH减小 |
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )。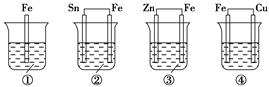
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是( )
| A.总反应式都为CH4+2O2=CO2+2H2O |
| B.H2SO4和NaOH的物质的量都不变,但浓度都减小 |
| C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O=CO2+4H+ |
| D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-=4OH- |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn+O2=2ZnO,下列判断正确的是( )
| A.放电时,OH-向负极方向移动 |
| B.放电时,正极反应式为Zn+2OH--2e-=ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
| D.充电时,阴极反应为O2+2H2O+4e-=4OH- |
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁—空气燃料电池工作原理示意图。下列有关该电池的说法正确的是( )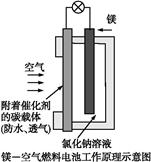
| A.该电池Mg作负极,发生还原反应 |
| B.该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C.电池工作时,电子通过导线由碳电极流向Mg电极 |
| D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
工业上常用Fe作电极电解处理含Cr2 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )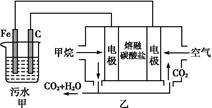
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C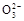 |
D.甲中阳极附近溶液中的离子反应方程式是:Cr2 +6Fe2++14H+=2Cr3++6Fe3++7H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O |
下列关于电化学知识说法正确的是( )
| A.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al |
| B.电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 |
| C.铅蓄电池在充电时,连接电源正极发生的电极反应为PbSO4+2e-=Pb+SO42- |
| D.将钢闸门与直流电流的负极相连,可防止钢闸门腐蚀 |