题目内容
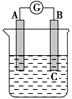
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )。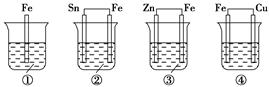
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
C
解析

练习册系列答案
相关题目
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是( )
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是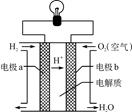
| A.该电池工作时化学能转化为电能 |
| B.该电池中电极b是正极,发生还原反应 |
| C.外电路中电流由电极a通过导线流向电极b |
| D.该电池的总反应:2H2+O2=2H2O |
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是 ( )。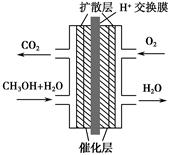
| A.通氧气的一极为负极 |
| B.H+从正极区通过交换膜移向负极区 |
| C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+ |
| D.甲醇在正极发生反应,电子经过外电路流向负极 |
如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是( )。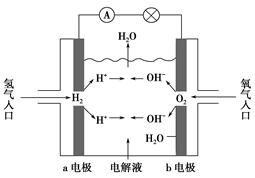
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-=2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )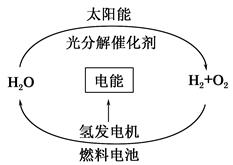
| A.燃料电池能够使化学反应产生的能量转化为电能 |
| B.燃料电池中通入H2的一极作负极,发生氧化反应 |
| C.在此循环中发生了反应:2H2O??2H2↑+O2↑ |
| D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B.放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH- |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )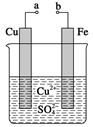
| A.a和b用导线连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为2H++2e-=H2↑ |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极 |