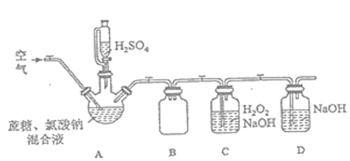
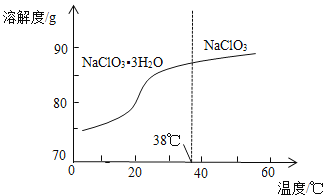
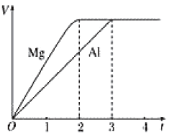
题目内容
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)Mn3+基态核外电子排布式为____。
(2)NO![]() 的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
(3)配合物[Mn(CH3OH)6]2+中配位原子是__。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为___。
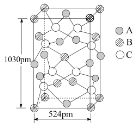
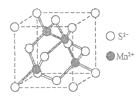
(5)MnS晶体具有α、β、γ三种形态,其中β-MnS的晶胞结构如图所示,则Mn2+的配位数为____。
【答案】[Ar]3d4或ls22s22p63s23p63d4 平面三角形 sp2,sp3 O CH3COOH分子与H2O分子间可形成氢键 4
【解析】
根据原子的电子排布式确定其离子的电子排布情况;根据等电子原理确定空间构型;有机物中的碳原子的杂化方式可以根据其成键情况进行判断;根据原子是否有孤电子对分析配位原子;根据氢键对物质的溶解性的影响分析物质的溶解性;根据晶胞结构确定原子的配位数。
(1)Mn的原子序数是25,其基态原子的电子排布式为ls22s22p63s23p63d54s2,则Mn3+基态核外电子排布式为[Ar]3d4或ls22s22p63s23p63d4。
(2)等电子体的空间构型相似,NO![]() 与BF3是等电子体,因为BF3的空间构型为平面三角形,故NO
与BF3是等电子体,因为BF3的空间构型为平面三角形,故NO![]() 的空间构型为平面三角形;CH3COOH分子中甲基上的碳原子形成4个σ键,故其为sp3杂化,羧基中的碳原子形成3个σ键和1个π键,故其轨道杂化类型为sp2。
的空间构型为平面三角形;CH3COOH分子中甲基上的碳原子形成4个σ键,故其为sp3杂化,羧基中的碳原子形成3个σ键和1个π键,故其轨道杂化类型为sp2。
(3)配合物[Mn(CH3OH)6]2+中配体是甲醇,只有氧原子含有孤对电子,配位原子是O。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为CH3COOH分子与H2O分子间可形成氢键。
(5)根据β-MnS的晶胞结构图Mn2+位于S2-形成的正四面体中,则Mn2+的配位数为4。

 名校课堂系列答案
名校课堂系列答案【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大