题目内容
17.常温下,甲为0.1mol/L BOH溶液,且溶液中$\frac{C(O{H}^{-})}{C({H}^{+})}$=1012请写出甲溶质B的电离子方程式BOH=B++OH-.分析 乙溶液中根据离子积常数和(OH-):c(H+)=1012 计算溶液中的氢氧根离子浓度分析判断BOH是强碱还是弱碱;依据强电解质、弱电解质写出电离方程式.
解答 解:甲溶液中$\frac{C(O{H}^{-})}{C({H}^{+})}$=1012,而溶液中离子积常数c(H+)•c(OH-)=10-14,可解得溶液中的氢氧根离子浓度c(OH-)=0.1mol/L,可知BOH是强碱,在溶液中能完全电离,故电离方程式为BOH=B++OH-,故答案为:BOH=B++OH-.
点评 本题考查了溶液中的氢离子、氢氧根的浓度的计算,根据碱的浓度和计算出的氢氧根的浓度来分析碱的强弱,题目难度不大.

练习册系列答案
相关题目
8.1L 0.1mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断中正确的是( )
| A. | AgNO3溶液的浓度减小 | B. | 阳极上产生O2 | ||
| C. | 转移的电子数为0.02NA个 | D. | 阴极发生了氧化反应 |
12.有A、B、C三种有机物,结构简式如下所示,试回答有关问题:
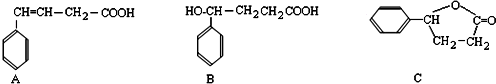
(1)A与C的关系为同分异构体.
(2)A→B的反应类型为加成反应.
(3)B→C的化学方程式为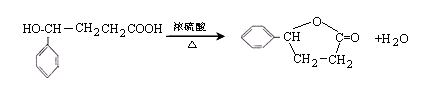 .
.
(4)A经加聚反应所得聚合物的结构简式为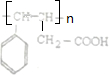 .
.

(1)A与C的关系为同分异构体.
(2)A→B的反应类型为加成反应.
(3)B→C的化学方程式为
 .
.(4)A经加聚反应所得聚合物的结构简式为
 .
.
2.下列分离混合物的方法中不正确的是( )
| A. | 从酒精和水的混合物中分离出酒精--蒸馏 | |
| B. | 使浑浊的食盐水变澄清--过滤 | |
| C. | 从碘水中分离出碘--分液 | |
| D. | 把硝酸钾和氯化钾从溶液中分离开来--结晶 |
9.已知钡的活性处于钾和钠之间,下列反应可以实现的是( )
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡与冷水剧烈反应置换出氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 在溶液中钡离子可以氧化金属锌,使之成为锌离子 |
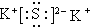 ,CO2的结构式为O=C=O.
,CO2的结构式为O=C=O.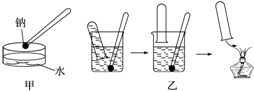 金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:
金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示: 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.