题目内容
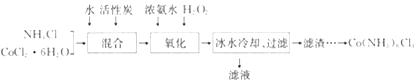
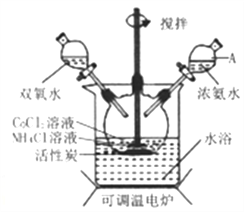
【题目】实验室利用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体Co(NH3)6Cl3,实验流程和装置图如下:
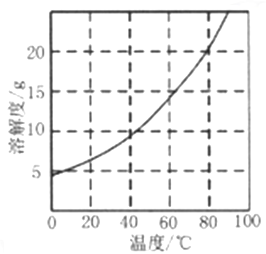
已知:①不同温度下,Co(NH3)6Cl3在水中溶解度曲线如图所示。
②Co(NH3)6Cl3 在溶液中主要以Co(NH3)63+和Cl- 形式存在,加入少量浓盐酸有利于结晶析出。
③Ksp[Co(OH)2]=1.09×10-15,Ksp[Co(OH)3]=1.6×10-44。
回答下列问题:
(1)图中仪器A的名称是_______;在实验过程中NH4Cl除作反应物外,还可防止在滴加氨水时生成粉红色Co(OH)2沉淀,其原理是_______。
(2)氧化过程在图所示装置中进行,生成Co(NH3)6Cl3。
①氧化时须先加入氨水,再加入H2O的目的是_______;该反应的离子方程式为_______。
②反应时需要控制温度在50~60℃之间,温度不能过高的原因是_______。
(3)冰水冷却的目的是_______ ;滤渣中所含有的主要杂质为_______。
(4)请完成由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,充分搅拌,趁热过滤,_______,再用少许乙醇洗涤,低温干燥。
(5)上述实验过程中若不使用活性炭作催化剂,则会得到紫红色晶体Co(NH3)5Cl3(M=250.5g·mol-1)。取2.505g紫红色晶体,溶于水后加入足量AgNO3溶液,生成白色沉淀2.870g,写出该反应的化学方程式:_______。
【答案】 分液漏斗 NH4Cl会抑制NH3·H2O的电离,防止pH过高 氨水提供NH3分子,与氧化生成的Co3+形成Co(NH3)63+,从而防止Co(OH)3的生成 H2O2+2Co2++2NH4++10NH3·H2O=2Co(NH3)63++12H2O 温度过高过氧化氢分解,氨气逸出 降低Co(NH3)6Cl3的溶解度,提高产量 活性炭 向滤液中加入少量浓盐酸,用冰水浴冷却后过滤 Co(NH3)5Cl3+2AgNO3=2AgCl↓+Co(NH3)5Cl(NO3)2
【解析】试题分析:由图中信息可知,实验室利用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,可以合成橙黄色晶体Co(NH3)6Cl3。由实验流程和装置图可知,在三口烧瓶中,双氧水把+2价Co氧化到+3价,NH4Cl的作用是抑制NH3·H2O的电离,防止pH过高。过滤后,滤渣中含活性炭和Co(NH3)6Cl3。
(1)仪器A的名称是分液漏斗;在实验过程中NH4Cl除作反应物外,还可防止在滴加氨水时生成粉红色Co(OH)2沉淀,其原理是NH4Cl会抑制NH3·H2O的电离,防止pH过高。
(2)①氧化时须先加入氨水,再加入H2O的目的是氨水提供NH3分子,与氧化生成的Co3+形成Co(NH3)63+,从而防止Co3+水解生成Co(OH)3;该反应的离子方程式为H2O2+2Co2++2NH4++10NH3·H2O=2Co(NH3)63++12H2O。
②反应时需要控制温度在50~60℃之间,温度不能过高的原因是温度过高过氧化氢分解,氨气逸出。
(3) 由Co(NH3)6Cl3在水中溶解度曲线可知,Co(NH3)6Cl3的溶解度随温度升高而显著增大,故冰水冷却的目的是降低Co(NH3)6Cl3的溶解度,提高产量;滤渣中所含有的主要杂质为活性炭。
(4)由Co(NH3)6Cl3在水中溶解度曲线可知,Co(NH3)6Cl3的溶解度随温度升高而显著增大,故提纯Co(NH3)6Cl3时可以可以采用重结晶法,又知加入少量浓盐酸有利于结晶析出,故可以设计由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案如下:将滤渣加入沸水中,充分搅拌,趁热过滤,向滤液中加入少量浓盐酸,用冰水浴冷却后过滤,再用少许乙醇洗涤,低温干燥。
(5)上述实验过程中若不使用活性炭作催化剂,则会得到紫红色晶体Co(NH3)5Cl3 (M=250.5g·mol-1)。取2.505g紫红色晶体,2.505g Co(NH3)5Cl3的物质的量为0.01mol,溶于水后加入足量AgNO3溶液,生成白色沉淀2.870g,该白色沉淀是AgCl,其物质的量为0.02mol,所以,Co(NH3)5Cl3的电离方程式为Co(NH3)5Cl3=[Co(NH3)5Cl]2++2Cl-,因此,该反应的化学方程式为Co(NH3)5Cl3+2AgNO3=2AgCl↓+Co(NH3)5Cl(NO3)2。

【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放。某含汞酸性废水(主要含Hg2+、H+、Na+、Cl-等)的处理工艺流程如下图所示:

请回答:
(1)含汞废水未经处理直接排放的危害是_________(填字母)
a.造成水体污染 b. 引起人体中毒
(2)调节pH时加入的溶液A可能是__________(填字母)
a. 盐酸 b. NaOH溶液
(3)图示所用到的废水处理方法为_____________,其中Na2S与Hg2+发生反应的离子方程式为________________________________________。
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl- | SO42- |
浓度(mol/L) | 3.0×10-4 | c | 2.0×10-4 | 2.5×10-4 |
则c(Fe2+) = ______________mol/L。