题目内容
【题目】某课外活动小组,称取了10.8g青铜进行研究,他们将青铜放入过量稀盐酸中,得到SnCl2和PbCl2的混合溶液,收集到的气体在101kPa下,冷却到25℃是272mL,冷却到10℃是267mL。已知该青铜合金中铜的质量分数是84.8%,试求该青铜合金中锡、铅的质量分数。
【答案】
Sn:7.9%;Pb:7.3%
【解析】
试题分析:设该青铜合金中锡、铅的物质的量分别为x、y。生成氢气的物质的量=![]() =0.011mol,根据Sn+2HCl=SnCl2+H2↑,Pb+2HCl=PbCl2+H2↑,
=0.011mol,根据Sn+2HCl=SnCl2+H2↑,Pb+2HCl=PbCl2+H2↑,
有x+y=0.011mol,118.7g/mol×x+207g/mol×y=10.8g×(1-84.8%),
解得:x=0.0072mol,y=0.0038mol,
合金中锡的质量分数=![]() ×100%=7.9%,
×100%=7.9%,
则合金中铅的质量分数=1-7.9%-84.8%=7.3%,故答案为:Sn:7.9%;Pb:7.3%。

练习册系列答案
相关题目
【题目】如右图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2 、HCl和O2 。供选用的试剂有:
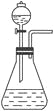
A.浓H2SO4 |
B.浓盐酸 |
C.食盐 |
D.二氧化锰 |
E.KMnO4
F.H2O2
(1)若要快速制备Cl2 应选择_____________________________;
(2)若要快速制备少量HCl,应选择_________________________;
(3)若要快速制备少量O2 ,应选择_________________________。