题目内容
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
(3)测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
-41.8
-41.8
kJ?mol-1.(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
b
b
.[不考虑N2O4(g)?2NO2(g)的转化]a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
(3)测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
2.67或
.
| 8 |
| 3 |
2.67或
.
.| 8 |
| 3 |
分析:(1)据盖斯定律来计算化学反应的焓变;
(2)根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
(2)据三行式以及化学平衡常数表达式计算化学平衡常数.
(2)根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
(2)据三行式以及化学平衡常数表达式计算化学平衡常数.
解答:解:(1)据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ?mol-1,则NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1,故答案为:-41.8;
(2)反应NO2(g)+SO2(g)?SO3(g)+NO(g)是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,
故选b;
(3)O2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=
a,故平衡常数为=x2/(1a-x)(2a-x)=
≈2.67,故答案为:2.67或
.
(2)反应NO2(g)+SO2(g)?SO3(g)+NO(g)是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,
故选b;
(3)O2(g)+SO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=
| 4 |
| 5 |
| 8 |
| 3 |
| 8 |
| 3 |
点评:本题将能量变化、化学平衡等知识柔和在一起进行考查,充分体现了高考的综合性,看似综合性较强的问题,只要细细分析,还是能各个突破的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
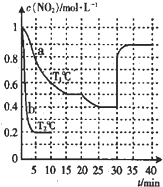 (2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.
(2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示. Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.