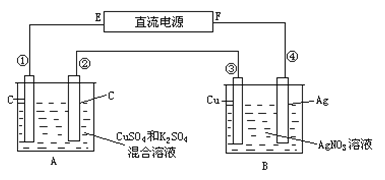
题目内容
【题目】Fe(OH)3可用来制颜料、药物,作净水剂。现设计实验研究制备Fe(OH)3的方法。
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-![]() Fe(OH)3
Fe(OH)3![]() H++FeO2-+H2O
H++FeO2-+H2O
(1)向3支盛有1 mL 1.0 mol·L-1 FeCl3溶液的试管中,分别加入3 mL不同浓度的NaOH溶液,都产生红褐色沉淀。充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如下:
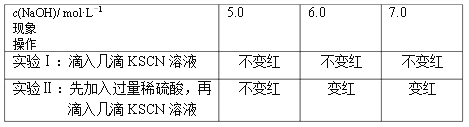
① 产生红褐色沉淀的离子方程式是________。
② 当c(NaOH)≥6.0 mol·L-1时,实验Ⅱ中溶液变红的原因是________、________(用离子方程式表示)。
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3。
① 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生。有同学提出沉淀中可能含有碳酸盐。将沉淀过滤、洗涤后取样,________,证明沉淀中含有碳酸盐。
② 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀。经检验沉淀中除Fe(OH)3外还含有FeSO3。产生FeSO3的原因是_________________。
(3)比较(1)和(2),制备Fe(OH)3的合理方法是___________(注明试剂和用量)。
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是________(写出一种即可)。
【答案】
(1)①Fe3++3OH-=Fe(OH)3↓;
②FeO2-+4H+=Fe3++2H2O;Fe3++3SCN-=Fe(SCN)3;
(2)①加入少量稀盐酸,有无色气体产生;
②2Fe3++SO32-+H2O=2Fe2++SO42-+2H+、Fe2++SO32-=FeSO3↓;
(3)1mL1.0mol·L-1FeCl3溶液与3mL浓度小于6.0mol·L-1的NaOH溶液;
(4)Na2O2、NaClO等;
【解析】
试题分析:(1)① 氯化铁与氢氧化钠反应生成红褐色沉淀,反应的离子方程式为Fe3+ + 3OH-=Fe(OH)3↓,故答案为:Fe3+ + 3OH-=Fe(OH)3↓;②新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-![]() Fe(OH)3
Fe(OH)3![]() H++FeO2-+H2O,当c(NaOH)≥6.0 mol·L-1时,FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3溶液变红,故答案为:FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3;
H++FeO2-+H2O,当c(NaOH)≥6.0 mol·L-1时,FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3溶液变红,故答案为:FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3;
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3。
① 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生。要证明沉淀中可能含有碳酸盐。只需要将沉淀过滤、洗涤后取样,加入少量稀盐酸,看是否有无色气体产生即可,故答案为:加入少量稀盐酸,有无色气体产生;
② 三价铁离子具有氧化性,与亚硫酸钠发生氧化还原反应,2Fe3+ + SO32-+H2O=2Fe2+ + SO42-+2H+,进而生成FeSO3,Fe2+ + SO32-=FeSO3↓,故答案为:2Fe3+ + SO32-+H2O=2Fe2+ + SO42-+2H+、Fe2+ + SO32-=FeSO3↓;
(3)比较(1)和(2)数据,pH大于等于6时,溶液中仍然含有铁离子,因此制备Fe(OH)3的合理方法是1 mL 1.0 mol·L-1 FeCl3溶液与3 mL浓度小于6.0 mol·L-1的NaOH溶液,故答案为:1 mL 1.0 mol·L-1 FeCl3溶液与3 mL浓度小于6.0 mol·L-1的NaOH溶液;
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂具有氧化性,能够将亚铁离子氧化为铁离子,同时生成的溶液具有碱性,该试剂可以是Na2O2、NaClO等,故答案为:Na2O2、NaClO等。