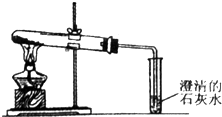
题目内容
3.它们的氯化物的化学式,最可能正确的是( )| A. | QCl2 | B. | RCl | C. | SCl3 | D. | TCl |
分析 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,
根据元素的化合价判断.
解答 解:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,不能形成氯化物;
R和V的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,其氯化物为RCl、VCl;
S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,其氯化物为SCl2;
T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,其氯化物为TCl3;
故选B.
点评 本题考查电离能知识,题目难度中等,注意原子的最外层电子数与电离能以及化合价的关系,注意根据化合价判断其氯化物的化学式.

练习册系列答案
相关题目
14.以下对核外电子运动状况的描述正确的是( )
| A. | 同一原子中,2p,3p,4p能级的轨道依次增多 | |
| B. | 当碳原子的核外电子排布由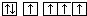 转变为 转变为 这一过程释放能量 这一过程释放能量 | |
| C. | 3p2表示3p能级有两个轨道 | |
| D. | 在同一能级上运动的电子,其运动状态可能相同 |
15.下列说法正确的是( )
| A. | 苯分子中含有碳碳双键 | |
| B. | 烃是指只含有碳、氢元素的有机物 | |
| C. | 燃烧后能产生C02和H20的有机物一定是烃 | |
| D. | 葡萄糖溶液中加人新制Cu(OH)2悬浊液,振荡,产生砖红色沉淀 |
12.下列化学电池不易造成环境污染的是( )
| A. | 锌锰电池 | B. | 氢氧燃料电池 | C. | 镍镉电池 | D. | 铅蓄电池 |
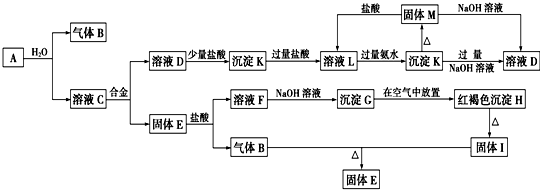
 .
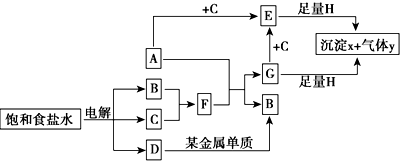
.
 .
. .
. .
.