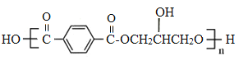��Ŀ����
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��F��G��ԭ��������������A��Eͬ�壬D��Fͬ�壬C���ӡ�D���Ӻ�E���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A���E�����Ԫ�ؾ����γɹ����ͻ����A��C�γɵĻ�������ˮ�гʼ��ԣ�C��D���ڣ�B���γɻ�������������Ԫ�ء�
�ش��������⣺
��1������Ԫ���У�ԭ�Ӱ뾶������_____����Ԫ�ط��ţ�����Ԫ�������ڱ��е�λ��_______
��2����A��D��E��Ԫ����ɵĻ�����û����ﺬ�еĻ�ѧ������Ϊ__________��
��3��A��B�γɵ�10���ӻ�����û�����Ŀռ乹��Ϊ__________
��4����A��C��D����Ԫ���γɵĻ�����Ⱥ������Ӽ��ֺ��й��ۼ����û�����Ļ�ѧʽΪ________
��5��������Ԫ����ɵ�����дһ����Ӧ����ʽ��Ҫ���ܹ�֤���ǽ�����G>F___
��6��A��D��D��E�γɵĻ����ﶼ����������ȡ����D���������ڹ��ۻ���������ȡ����D�ķ�Ӧ����ʽΪ___________
���𰸡�Na ��������IA�� ���Ӽ��������ԣ����ۼ� �������� NH4NO3 Cl2��H2S=2HCl��S�� 2H2O2 ![]() 2H2O��O2��
2H2O��O2��
��������
A��C�γɵĻ�������ˮ�гʼ��ԣ��û�����ΪNH3����AΪH��CΪN��C��D���ڣ��Ƴ�DΪO��B���γɻ�������������Ԫ�أ���BΪC����Ϊ�Ƕ�����Ԫ�أ���ԭ��������������A��Eͬ�壬��EΪNa��D��Fͬ���壬��FΪS��GΪCl��������
A��C�γɵĻ�������ˮ�гʼ��ԣ��û�����ΪNH3����AΪH��CΪN��C��D���ڣ��Ƴ�DΪO��B���γɻ�������������Ԫ�أ���BΪC����Ϊ�Ƕ�����Ԫ�أ���ԭ��������������A��Eͬ�壬��EΪNa��D��Fͬ���壬��FΪS��GΪCl��
��1������ͬ������ϵ��£�ԭ�Ӱ뾶����ͬ���ڴ�������ԭ�Ӱ뾶��С��������ֶ�������ԭ�Ӱ뾶������Na��λ�ڵ�������IA�壻
��2��A��D��E����Ԫ����ɵĻ�������NaOH��NaOH�������ӻ�����������Ӽ���(����)���ۼ���
��3��A��B�γ�10���ӻ�������CH4����ռ乹��Ϊ���������Σ�
��4���������Ӽ����û�����Ϊ���ӻ������H��N��O��ɵĻ�����Ϊ��Σ���ѧʽΪNH4NO3��
��5��֤���ǽ�����Clǿ��S�����Բ����û���Ӧ����Cl2��H2S=2HCl��S����
��6��A��D���ɵĻ�������H2O��H2O2��D��E�γɵĻ�����Na2O��Na2O2��������ȡ����O2��ǰ��ΪH2O2������ΪNa2O2�����ڹ��ۻ��������H2O2������Ӧ����ʽΪ2H2O2 ![]() 2H2O��O2����
2H2O��O2����