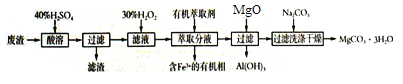
题目内容
【题目】图1是元素周期表的一部分.表中所列的字母分别代表一种化学元素. 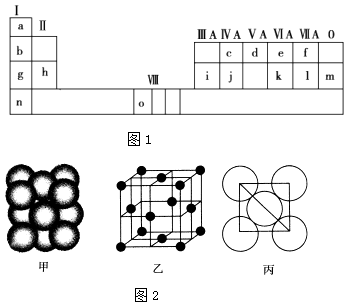
试回答下列问题:
(1)请写出元素o的基态原子外围电子排布式 .
(2)d的氢化物的分子构型为 , 中心原子的杂化形式为;k在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(填“极性”或“非极性”)分子.
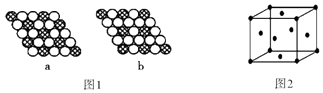
(3)i单质晶体中原子的堆积方式如图2甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示. 若已知i的原子半径为d cm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为 , 一个晶胞中i原子的数目为 .
②该晶体的密度为(用字母表示).
【答案】
(1)1s22s22p63s23p63d64s2
(2)三角锥形;sp3;V型;sp2;极性
(3)12;4;![]() ?g/cm3
?g/cm3
【解析】解:(1)由元素在周期表中的位置可知,元素o处于第四周期第Ⅷ族,为26号元素Fe,原子核外有26个电子,根据构造原理其核外电子排布式为:1s22s22p63s23p63d64s2 , 所以答案是:1s22s22p63s23p63d64s2;(2)d为N,其氢化氢为NH3 , N原子有1对孤对电子,成键数为3,N原子为sp3杂化,为三角锥形;k为S元素,在空气中燃烧生成SO2 , S有1对孤对电子,存在S=O键,S原子采取sp2杂化,V型,正负电荷中心不重合,为极性分子,
所以答案是:三角锥形;sp3;V型;sp2;极性;(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;晶胞中含有原子数目=8× ![]() +6×
+6× ![]() =4,
=4,
所以答案是:12;4;②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为, ![]() ×4dcm=2
×4dcm=2 ![]() d cm,晶胞体积为(2
d cm,晶胞体积为(2 ![]() dcm)3=16
dcm)3=16 ![]() d3cm3 , 晶胞中含有原子数目=8×
d3cm3 , 晶胞中含有原子数目=8× ![]() +6×
+6× ![]() =4,
=4,
相对原子质量为M,故晶胞的质量=4× ![]() g,故晶体的密度=
g,故晶体的密度= 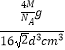 g/cm3=
g/cm3= ![]() g/cm3 ,
g/cm3 ,
所以答案是: ![]() g/cm3 .
g/cm3 .

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案