题目内容
3.下列叙述正确的是( )| A. | 3.01×1023个SO2分子的质量为32g | B. | CH4的摩尔质量为16g | ||
| C. | 1molH2O的质量为18g/mol | D. | O的摩尔质量是32g/mol |
分析 摩尔质量的单位为g/mol,在数值上等于物质的相对分子质量或相对原子质量,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
解答 解:A.n(SO2)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,n(SO2)=0.5mol×64g/mol=32g,故A正确;
B.CH4的摩尔质量为16g/mol,单位错误,故B错误;
C.1molH2O的质量为18g,故C错误;
D.O的摩尔质量是16g/mol,故D错误.
故选A.
点评 本题考查了物质的量的简单计算,为高频考点,题目难度中等,要求学生熟练掌握物质的量、摩尔质量、气体摩尔体积间的转化关系,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
14.为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
18.自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式.火炬的可燃物是丁烷 (化学式为 C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见.下列关于丁烷的叙述不正确的是( )
| A. | 丁烷由碳、氢两种元素组成 | |
| B. | 丁烷由4个碳原子和10个氢原子构成 | |
| C. | 丁烷中碳、氢元素的质量比是24:5 | |
| D. | 丁烷分子由碳原子和氢原子构成 |
8.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:A(g)+3B(g)?2C(g),能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 体系的压强不再发生变化 | B. | 3v正(B)═2v逆(C) | ||
| C. | 混合气体密度不再变化 | D. | 消耗1molA的同时生成2molC |
15.生活中处处有化学,下列叙述错误的是( )
| A. | 医用酒精的浓度通常为75% | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
1.苯甲酸广泛应用于制药和化工行业.某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下:
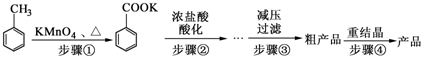
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
(1)将步骤①得到混合物加少量水,分离有机相和水相.有机相在上(填“上”或“下”)层;实验操作的名称是分液.
(2)步骤②用浓盐酸酸化的目的是使苯甲酸析出.
(3)减压过滤装置所包含的仪器除减压系统外,还有布氏漏斗、吸滤瓶(填仪器名称).
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是其它杂质也有可能析出.
(5)重结晶时需要趁热过滤,目的是为了减少苯甲酸的损失.

甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 | 易溶 | ||
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
(2)步骤②用浓盐酸酸化的目的是使苯甲酸析出.
(3)减压过滤装置所包含的仪器除减压系统外,还有布氏漏斗、吸滤瓶(填仪器名称).
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是其它杂质也有可能析出.
(5)重结晶时需要趁热过滤,目的是为了减少苯甲酸的损失.
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |