题目内容
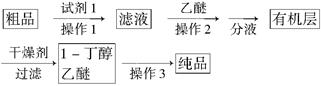
(16分)某学习小组以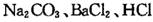 溶液作试剂,设计提纯含有少量
溶液作试剂,设计提纯含有少量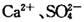 的粗盐。其实验方案如下:
的粗盐。其实验方案如下:
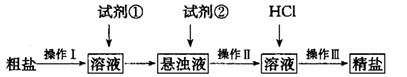
(1) 操作I的名称为________;试剂①应选用_______;检验试剂②是否过量的方法______。
(2) 操作I〜III共用到玻璃棒________次;从悬浊液到精盐的实验过程中,某同学未按上述方案进行,最终导致精盐纯度偏低。其做法可能是________________。
(3)测定产品精盐中NaCl的含量的实验步骤是:
第一步:准确称取a g干燥精盐于锥形瓶中,加人30. OmL蒸馏水。
第二步:向上述锥形瓶中加人几滴突光素指示剂。
第三步:用浓度为的AgNO3标液滴至终点(溶液呈浅红色),消耗AgNO3溶液V mL。
①盛装干燥精盐的烧杯应放在________中保存(填仪器名称);
②终点时溶液呈浅红色是荧光素指示剂与________反应(填“Ag+”或"NO3-”);
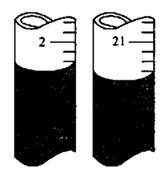
③某同学在第二次滴定时,滴定前,后管内液面分别如图,则其所得V=________mL;
④NaCl的质量分数为________ (用字母表示)
(1)除去;BaCl2溶液;静止悬浊液,取适量的的上层清液于试管中,滴入适量碳酸钠溶液,若不出现混浊则试剂②已经过量,反之则不过量。
(2)3;将过滤与加盐酸顺序颠倒或盐酸用量不足或蒸发时尚有大量水未蒸干
(3)干燥器;Ag+;19.10;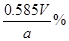
【解析】除Ca2+和SO42-分别需要碳酸钠和氯化钡,但过量的氯化钡还需要碳酸钠来除去,因此在除去Ca2+前需要先除去SO42-,多余的碳酸钠可用盐酸来除去。但再加入盐酸之前要先过滤除去沉淀,然后才能加入盐酸。试剂②是碳酸钠溶液,若碳酸钠不过量,则继续加入会产生白色沉淀,所以检验其是否过量的方法为:静止悬浊液,取适量的的上层清液于试管中,滴入适量碳酸钠溶液,若不出现混浊则试剂②已经过量,反之则不过量;若所制取的精盐纯度偏低有可能是加盐酸前没有过滤,或盐酸量不足或蒸发时尚有大量水未蒸干;为了防止精盐吸水需要放在干燥器中。因为Ag+与Cl-结合生成了白色沉淀,而NO3-并没有参与反应,所以只有当Ag+过量是才能发生颜色的变红,因此荧光素指示剂与反应的Ag+。滴定前后的读数分别未2、30ml和21.40ml,所以V=19.10mL。消耗AgNO3的量是0.0001Vmol,所以氯化钠的质量是5.85V×10-3g,所以NaCl的质量分数为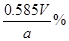 。
。

 CH3CH2CH2CHO
CH3CH2CH2CHO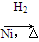 CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH: CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。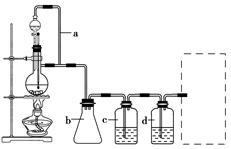
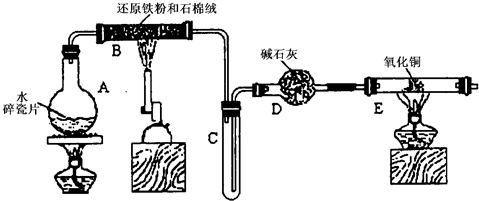
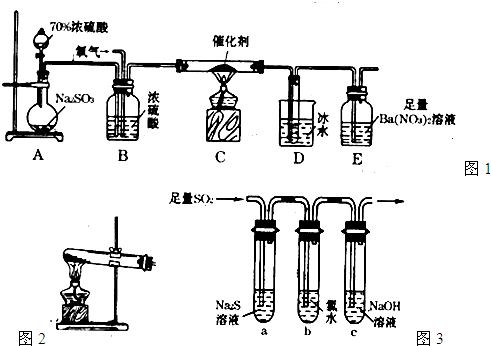
 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。


