题目内容
(2009?静安区一模)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器).
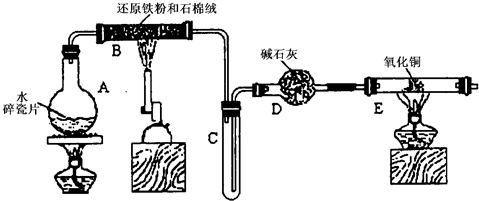
(1)仪器B的名称是
(2)B中发生反应的化学方程式是
(3)加热E以前要对装置中的气体验纯,方法是:收集一试管气体,然后
(4)已知有反应:Cu20+2H+→Cu+Cu2++H20,则可用来检验反应后E中的红色固体中除Cu外是否含Cu20,可用的试剂是
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(5)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成或铜的相对原子质量.若反应前盛有药品的E、F的质量分别是bg、cg,反应后分别是dg、eg.
①水中元素的物质的量之比可表示为n(H):n(0)=
②若空的E管的质量为ag,加热后CuO完全还原为Cu,则铜的相对原子质量可表示为
.

(1)仪器B的名称是
石英管或硬质玻璃管
石英管或硬质玻璃管
,石棉绒的作用是增大铁与水蒸气接触面积,防止加热时固体喷入导管
增大铁与水蒸气接触面积,防止加热时固体喷入导管
.(2)B中发生反应的化学方程式是
3Fe+4H2O(g)
Fe3O4+H2
| ||
3Fe+4H2O(g)
Fe3O4+H2
.
| ||
(3)加热E以前要对装置中的气体验纯,方法是:收集一试管气体,然后
将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯
将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯
.(4)已知有反应:Cu20+2H+→Cu+Cu2++H20,则可用来检验反应后E中的红色固体中除Cu外是否含Cu20,可用的试剂是
bc
bc
(填序号)a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(5)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成或铜的相对原子质量.若反应前盛有药品的E、F的质量分别是bg、cg,反应后分别是dg、eg.
①水中元素的物质的量之比可表示为n(H):n(0)=
e-c-(b-d):
| b-d |
| 16 |
e-c-(b-d):
;若反应后E中除Cu外还含有另种还原产物Cu20,则该比值将| b-d |
| 16 |
无影响
无影响
(选填“偏大”“偏小”或“无影响”).②若空的E管的质量为ag,加热后CuO完全还原为Cu,则铜的相对原子质量可表示为
| 16(d-a) |
| b-d |
| 16(d-a) |
| b-d |
分析:(1)依据图装置仪器分析,E为固体加热反应的装置,应在硬质玻璃管或石英管中加热;石棉绒可以增大铁与水蒸气的接触面积,防止固体粉末喷入导气管;
(2)B是铁和水蒸气发生的反应生成四氧化三铁和氢气;
(3)氢气纯度的检验方法分析;
(4)依据反应Cu20+2H+→Cu+Cu2++H20可知,反应是氧化亚铜在非氧化性酸溶液中的歧化反应,用来检验反应后E中的红色固体中除Cu外是否含Cu20,固体溶解后溶液呈蓝色证明含有氧化亚铁;酸不能选择氧化性的酸,因为氧化性的酸可以氧化亚铜离子,溶解金属铜;
(5)E装置发生反应为CuO+H2
Cu+H2O,固体质量减小计算氧元素的质量;结合F吸收水的质量减去氧元素质量为氢元素质量,再计算氢元素和氧元素物质的量之比;在E后若再接二个盛碱石灰的干燥管F为吸收生成的水蒸气,G是防止空气中水蒸气和二氧化碳进入影响测定结果;结合质量变化和化学方程式计算得到.
(2)B是铁和水蒸气发生的反应生成四氧化三铁和氢气;
(3)氢气纯度的检验方法分析;
(4)依据反应Cu20+2H+→Cu+Cu2++H20可知,反应是氧化亚铜在非氧化性酸溶液中的歧化反应,用来检验反应后E中的红色固体中除Cu外是否含Cu20,固体溶解后溶液呈蓝色证明含有氧化亚铁;酸不能选择氧化性的酸,因为氧化性的酸可以氧化亚铜离子,溶解金属铜;
(5)E装置发生反应为CuO+H2
| ||
解答:解:(1)依据图装置仪器分析,E为固体加热反应的装置,应在硬质玻璃管或石英管中加热;石棉绒可以增大铁与水蒸气的接触面积,防止固体粉末喷入导气管,
故答案为:石英管或硬质玻璃管;增大铁与水蒸气接触面积,防止加热时固体喷入导管;
(2)B装置中是铁和水蒸气发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+H2 ,故答案为:3Fe+4H2O(g)
Fe3O4+H2;
(3)氢气是可燃性气体混有空气会发生爆炸,需要验纯实验验证,方法是:收集一试管气体,将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯,
故答案为:将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯;
(4)反应Cu20+2H+→Cu+Cu2++H20可知,反应是氧化亚铜在非氧化性酸溶液中的歧化反应,用来检验反应后E中的红色固体中除Cu外是否含Cu20,固体溶解后溶液呈蓝色证明含有氧化亚铜;酸不能选择氧化性的酸,因为氧化性的酸可以氧化亚铜离子,溶解金属铜;选项中a是强氧化性酸溶解氧化亚铜和铜,不能检验;b是非氧化性酸可以加入,发生题干反应验证氧化亚铜的存在;c、盐酸是非氧化性酸可以发生题干反应,氧化亚铜溶解,铜不反应,验证氧化亚铜的存在;d浓硫酸是强氧化性酸,和铜、氧化亚铜反应,不能证明氧化亚铜的存在,故答案为:bc;
(5)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),在E后若再接二个盛碱石灰的干燥管F为吸收生成的水蒸气,G是防止空气中水蒸气和二氧化碳进入影响测定结果;若反应前盛有药品的E、F的质量分别是bg、cg,反应后分别是dg、eg;
①则在E装置中反应前后质量减少为氧元素的质量=b-d,所以F装置中吸收的水的质量=e-c;所以氢元素质量=e-c-(b-d);计算得到氢元素物质的量和氧元素物质的量之比=e-c-(b-d):
;反应后E中除Cu外还含有另种还原产物Cu20,反应前后减少的仍是氧元素的质量,H2+CuO=Cu+H2O;Cu2O+H2=H2O+2Cu,依据反应化学方程式可知,固体质量变化的都是氧元素的质量且相同,所以,生成氧化亚铜对测定结果无影响,故答案为:e-c-(b-d):
;无影响;
②若空的E管的质量为ag,则氧化铜的质量=b-a;加热后CuO完全还原为Cu,质量减少为氧元素质量=b-d;设铜的摩尔质量为X,依据氧元素物质的量相等得到:
=
,得到X=
.故答案为:
.
故答案为:石英管或硬质玻璃管;增大铁与水蒸气接触面积,防止加热时固体喷入导管;
(2)B装置中是铁和水蒸气发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)
| ||
| ||
(3)氢气是可燃性气体混有空气会发生爆炸,需要验纯实验验证,方法是:收集一试管气体,将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯,
故答案为:将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯;
(4)反应Cu20+2H+→Cu+Cu2++H20可知,反应是氧化亚铜在非氧化性酸溶液中的歧化反应,用来检验反应后E中的红色固体中除Cu外是否含Cu20,固体溶解后溶液呈蓝色证明含有氧化亚铜;酸不能选择氧化性的酸,因为氧化性的酸可以氧化亚铜离子,溶解金属铜;选项中a是强氧化性酸溶解氧化亚铜和铜,不能检验;b是非氧化性酸可以加入,发生题干反应验证氧化亚铜的存在;c、盐酸是非氧化性酸可以发生题干反应,氧化亚铜溶解,铜不反应,验证氧化亚铜的存在;d浓硫酸是强氧化性酸,和铜、氧化亚铜反应,不能证明氧化亚铜的存在,故答案为:bc;
(5)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),在E后若再接二个盛碱石灰的干燥管F为吸收生成的水蒸气,G是防止空气中水蒸气和二氧化碳进入影响测定结果;若反应前盛有药品的E、F的质量分别是bg、cg,反应后分别是dg、eg;
①则在E装置中反应前后质量减少为氧元素的质量=b-d,所以F装置中吸收的水的质量=e-c;所以氢元素质量=e-c-(b-d);计算得到氢元素物质的量和氧元素物质的量之比=e-c-(b-d):
| b-d |
| 16 |
| b-d |
| 16 |
②若空的E管的质量为ag,则氧化铜的质量=b-a;加热后CuO完全还原为Cu,质量减少为氧元素质量=b-d;设铜的摩尔质量为X,依据氧元素物质的量相等得到:
| b-a |
| X+16 |
| b-d |
| 16 |
| 16(d-a) |
| b-d |
| 16(d-a) |
| b-d |
点评:本题考查了铁铜及其化合物性质的应用,主要是实验装置分析和实验目的判断应用,实验验证可燃气体纯度的方法,实验测定后的元素之力计算,题目难度较大.

练习册系列答案
相关题目






 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 .
.

 的水解产物
的水解产物 不能经氧化反应⑥得到产品
不能经氧化反应⑥得到产品