题目内容
【题目】请根据物质的量相关计算填空
(1)19.6 g 硫酸是_____mol H2SO4 ,1.7 gNH3 在同温同压下与_____g H2S 气体含有的氢原子数相同。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,该气体的物质的量是_____,R 的相 对原子量为_____。
(3)已知 Wg 气体 A 含有 a 个分子,那么在标准状况下,bg 气体 A 所占的体积是 _____L (其中阿 伏加德罗常数用 NA 表示)
(4)标准状况下,密度为 0.75g/L 的 NH3 与 CH4 组成的混合气体中,NH3 的体积分数_______________, 混合气体的平均摩尔质量为_____, 该气体对氢气的相对密度为__________________。
【答案】0.2 5.1 0.025 32 22.4ab/wNA 80% 16.8g/mol 8.4
【解析】
(1)硫酸的物质的量n=![]() ;而硫酸为7原子分子,据此计算硫酸中的原子的物质的量和个数;求出氨气的物质的量,然后根据氨气中含3个H原子来计算出其含有的H原子的物质的量,然后根据H2S中含2个H原子,求出H2S的物质的量,并根据质量m=nM来计算;
;而硫酸为7原子分子,据此计算硫酸中的原子的物质的量和个数;求出氨气的物质的量,然后根据氨气中含3个H原子来计算出其含有的H原子的物质的量,然后根据H2S中含2个H原子,求出H2S的物质的量,并根据质量m=nM来计算;
(2)根据其体积求出物质的量,然后根据摩尔质量M=![]() mn计算;而相对分子质量在数值上等于摩尔质量,故R的相对原子质量=相对分子质量-32;
mn计算;而相对分子质量在数值上等于摩尔质量,故R的相对原子质量=相对分子质量-32;
(3)Wg气体A含有a个分子,设bg气体含有的分子数为x个,则有:![]() =ax,解得x值;然后根据体积V=
=ax,解得x值;然后根据体积V=![]() Vm来计算体积;
Vm来计算体积;
(4)根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中NH3和CH4的体积比.然后根据密度之比等于摩尔质量之比来计算。
(1)19.6 g 硫酸的物质的量n=![]() =
=![]() mol;
mol;
1.7g氨气的物质的量为n=![]() =0.1mol,而氨气中含3个H原子,故0.1mol氨气中含0.3molH原子,而H2S中含2个H原子,故含相同H原子数的H2S的物质的量为n=
=0.1mol,而氨气中含3个H原子,故0.1mol氨气中含0.3molH原子,而H2S中含2个H原子,故含相同H原子数的H2S的物质的量为n=
![]() =0.15mol,质量m=nM=0.15mol×34g/mol=5.1g;
=0.15mol,质量m=nM=0.15mol×34g/mol=5.1g;
(2) 标准状况下,Vm=222.4L/mol,1.6g某气态氧化物RO2的体积为0.56L,其物质的量为
![]() =0.025mol,其摩尔质量为
=0.025mol,其摩尔质量为![]() =64g/mol,故RO2的相对分子质量为64,则R的相对原子质量=64-16×2=32;
=64g/mol,故RO2的相对分子质量为64,则R的相对原子质量=64-16×2=32;
(3)已知 Wg 气体 A 含有 a 个分子,那么在标准状况下,bg 气体 A 所占的体积是 _____L (其中阿 伏加德罗常数用 NA 表示)
(4) 混合气体在标准状况下的密度为0.75g/L,
则混合气体的平均摩尔质量为0.75g/L×22.4L/mol=16.8g/mol,
根据十字交叉法计算混合气体中NH3和CH4的体积比:
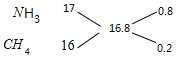
所以混合气体中NH3和CH4的体积比为0.8:0.2=4:1,
即氨气的体积分数=![]() ×100%=80%;
×100%=80%;
由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为![]() =8.4。
=8.4。