��Ŀ����
����Ŀ��ij��Ӧ�з�Ӧ������������:FeCl2��FeCl3��CuCl2��Cu
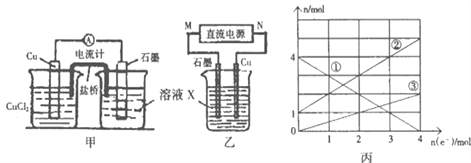
(1)��������Ӧ��Ƴɵ�ԭ�����ͼ����ʾ����ش���������:
��ͼ��X��Һ��___________
��Cu�缫�Ϸ����ĵ缫��ӦʽΪ__________
��ԭ��ع���ʱ�������е�_____����(�K+����Cl-��)���Ͻ���X��Һ�С�
(2)��������Ӧ��Ƴɵĵ�����ͼ����ʾ�����ձ��н��������ӵ����ʵ��������ת�Ƶ����ʵ����ı仯��ϵ��ͼ������ش���������:
��M��______��;
��ͼ���еĢ�����_________���ӵı仯��
�۵�����ת��Ϊ2molʱ�������ձ��м���_____L5mol/LNaOH��Һ����ʹ���еĽ��������ӳ�����ȫ��
(3)������Ҫ�������������(Na2FeO4)��һ����������ˮ�����������кܶ��ŵ㡣
�ٸ���������������֮һ�ǵ�ⷨ����ԭ��ΪFe+2NaOH+2H2O![]() Na2FeO4+3H2��,����ʱ�����ĵ缫��Ӧʽ��__________
Na2FeO4+3H2��,����ʱ�����ĵ缫��Ӧʽ��__________
�ڸ���������������֮������ǿ���Խ�������NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ�ˮ���÷�Ӧ�����ӷ���ʽΪ___________
���𰸡� FeCl3��FeCl2 Cu-2e-=Cu2+ K+ �� Fe2+ 2.8 Fe+8OH--6e-=FeO42-+4H2O 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
��������(1) ���ɷ�Ӧ�Ļ�ѧ����ʽCu��2FeCl3===2FeCl2��CuCl2�����Ե������ҺX��FeCl2��FeCl3�Ļ����Һ���𰸣�FeCl3��FeCl2��
��Cu�缫Ϊԭ��صĸ������缫��ӦʽΪCu��2e��===Cu2���������е�K���������ƶ�����X��Һ�С��𰸣�Cu-2e-=Cu2+ K+��
(2) �ٵ��ʱCu�ܽⷢ��������Ӧ����Cu�缫Ϊ������NΪ��Դ��������MΪ��Դ�ĸ������𰸣�����
�����ʱ������Cu��2e��===Cu2����������2Fe3����2e��===2Fe2�����������Һ��Fe2����Cu2�������ʵ�������������ʼʱCu2�������ʵ���Ϊ0���ʢ��߱�ʾFe2���ı仯���𰸣�Fe2+
��������ת��2 molʱ����Һ��n(Fe3��)��4 mol��2 mol��2 mol��n(Fe2��)��1 mol��2 mol��3 mol��n(Cu2��)��1 mol��Ҫʹ���еĽ��������ӳ�����ȫ������NaOH�����ʵ���Ϊ��2 mol��3��3 mol��2��1 mol��2��14 mol����NaOH��Һ�����Ϊ14 mol��5 mol��L��1��2.8 L���𰸣�2.8
��3����������ʧ���ӻ��ϼ����߷���������Ӧ,����Ԫ�ػ��ϼ۱仯֪,��������ʧ���Ӻ��������ڷ�Ӧ���ɸ�������,�缫��ӦʽΪFe+8OH--6e-=FeO42-+4H2O��ˣ�������ȷ����: Fe+8OH--6e-=FeO42-+4H2O
����ǿ���Խ�������NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ�ˮ���÷�Ӧ�����ӷ���ʽΪ 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O���𰸣�2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
