题目内容
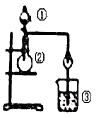
【题目】X、Y、Z、M、N、q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是( ) 
A.金属性:N>Q
B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X
D.原子序数:Z>M>X>Y
【答案】BD
【解析】解:X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为﹣2价,没有正化合价,故X为O元素,M的化合价为+6、﹣2价,故M为S元素;Z的最高正价为+7价、最低价﹣1,则Z为Cl元素;Y的化合价为+4、﹣4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素, A.同周期自左而右金属性减弱,故金属性Na>Al,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性高氯酸>硫酸>偏铝酸,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2﹣>Na+>Al3+ , 故C错误;
D.根据分析可知原子序数大小为:Z(Cl)>M(S)>X(O)>Y(C),故D正确;
故选BD.
X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为﹣2价,没有正化合价,故X为O元素,M的化合价为+6、﹣2价,故M为S元素;Z的最高正价为+7价、最低价﹣1,则Z为Cl元素;Y的化合价为+4、﹣4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素,据此进行解答.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】有A,B,C,D,E五种原子序数小于18的元素,其特征信息如下表:
元素编号 | 特征信息 |
A | 有一种原子内只有质子,没有中子 |
B | L层电子数是K层的3倍 |
C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
E | 单质为黄绿色,可用于制造漂白粉 |
请回答下列问题:
(1)A,B,C三种元素形成的化合物含有的化学键类型是 .
(2)由A,B,C元素中两两组合形成的化合物相互反应生成单质的化学方程式是 .
(3)D单质与A,E形成的化合物的水溶液反应的离子方程式是 .
(4)写出实验室制取单质E的化学方程式: .
(5)C和D两元素形成的单质活泼性较强的是(写元素符号) , 你的判断依据是 .
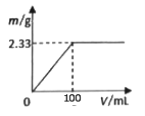
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
A.A
B.B
C.C
D.D