题目内容
【题目】氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
(1)过程Ⅰ:加NaOH溶液,调节pH至11后,并鼓入大量空气。用离子方程式表示加NaOH溶液的作用是______________;用化学平衡理论解释鼓入大置空气的目的__________________。
(2) II中加入适量NaClO溶液,控制pH在3~4,将NH4+转化为无毒物质。则反应的离子方程式是__________________。
(3)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
①将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为__________。
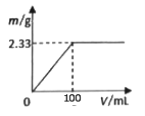
②另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_______ (溶液体积变化忽略不计)。
【答案】 NH4++OH﹣=NH3H2O 空气可以将生成的氨气带走,使NH3H2O![]() NH3+ H2O化学平衡向正反应方向移动,利于除氨 3ClO﹣+2NH4+=N2↑+3Cl﹣+2H++3H2O 1:2 0.1 mol·Lˉ1
NH3+ H2O化学平衡向正反应方向移动,利于除氨 3ClO﹣+2NH4+=N2↑+3Cl﹣+2H++3H2O 1:2 0.1 mol·Lˉ1
【解析】(1)铵盐能和强碱反应,实质是:NH4++OH-═NH3H2O,故答案为:NH4++OH-═NH3H2O;氨水电离是可逆反应,将生成的氨气带走,即减少生成物,可以使化学平衡向正反应方向移动,即更多的生成氨气,因而促进了氨水电离,故答案为:空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离;(2)加入适量NaClO溶液,控制pH在3~4,将NH4+转化为无毒物质,可以确定NH4+被氧化为N2,ClO—被还原为氯离子,根据电子守恒、电荷守恒可写出此离子方程式:3ClO﹣+2NH4+=N2↑+3Cl﹣+2H++3H2O;
(3)①沉淀2.33g为BaSO4,那么n(BaSO4)=n[(NH4)2SO4]= n[Ba(OH)2]==0.01mol,m[(NH4)2SO4]=1.32g,m(NH4Cl)=1.07g,m(NH4Cl)=0.02mol。②由①可知,体积为100mL氢氧化钡溶液的物质的量为0.01mol,则氢氧化钡溶液的浓度为0.01mol/0.1L==0.1mol/L,2.39 g (NH4)2SO4和NH4Cl固体混合物铵根离子的物质的量为0.01×2+0.02==0.04mol, 又因为n(NH4+)==n(OH—)== 0.04mol,则需要n[Ba(OH)2]==0.02mol,所需要溶液体积为200mL,反应中氯离子的物质的量不变,混合物中n(Cl—)== 0.02mol,c(Cl—)== 0.02mol/0.2L==0.1mol/L。


