题目内容
【题目】有A,B,C,D,E五种原子序数小于18的元素,其特征信息如下表:
元素编号 | 特征信息 |
A | 有一种原子内只有质子,没有中子 |
B | L层电子数是K层的3倍 |
C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
E | 单质为黄绿色,可用于制造漂白粉 |
请回答下列问题:
(1)A,B,C三种元素形成的化合物含有的化学键类型是 .
(2)由A,B,C元素中两两组合形成的化合物相互反应生成单质的化学方程式是 .
(3)D单质与A,E形成的化合物的水溶液反应的离子方程式是 .
(4)写出实验室制取单质E的化学方程式: .
(5)C和D两元素形成的单质活泼性较强的是(写元素符号) , 你的判断依据是 .
【答案】
(1)离子键、(极性)共价键
(2)2Na2O2+2H2O=4NaOH+O2↑
(3)2Al+6H+=2Al3++3H2↑
(4)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(5)Na;Na可与冷水剧烈反应,Al不与水反应
【解析】解:A,B,C,D,E五种原子序数小于18的元素,A其中一种原子核内只有质子没有中子,则A为H元素;B原子的L层电子数是K层的3倍,其L层含有6个电子,为O元素;C阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3,则C为Na元素;D原子的最外层电子数等于电子层数,且是地壳中含量较多的元素之一,则为Al元素;E单质为黄绿色气体,可用于制造漂白粉,则E为Cl元素,(1)由H、O、Na三种元素形成的化合物是氢氧化钠,氢氧化钠中含有离子键和共价键,所以答案是:离子键、(极性)共价键;(2)由H、O、Na元素中两两组合形成的化合物为过氧化钠和水,因为过氧化钠和水能反应生成氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,所以答案是:2Na2O2+2H2O=4NaOH+O2↑;(3)D的单质为Al,A,E形成的化合物为HCl,铝与盐酸反应生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al3++3H2↑,所以答案是:2Al+6H+=2Al3++3H2↑;(4)E的单质为氯气,实验室中常用二氧化锰与浓盐酸反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O, 所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O, 所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(5)C的单质为Na,D的单质为金属铝,Na可与冷水剧烈反应,Al不与水反应,则金属钠的活泼性较强,
MnCl2+Cl2↑+2H2O;(5)C的单质为Na,D的单质为金属铝,Na可与冷水剧烈反应,Al不与水反应,则金属钠的活泼性较强,
所以答案是:Na;Na可与冷水剧烈反应,Al不与水反应.

 赢在课堂名师课时计划系列答案
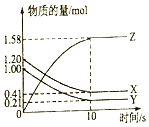
赢在课堂名师课时计划系列答案【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 
(1)该反应的化学方程式为 .
(2)反应开始至2min,气体Z的反应速率为 .
(3)若X、Y、Z均为气体,反应达到平衡时,压强是开始时的倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热△H= .
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.已知:
化学键 | H﹣H | H﹣Cl | Cl﹣Cl |
键能/KJmol﹣1 | 436 | 431 | 242 |
工业上通过氢气在氯气中充分燃烧制取HCl气体,写出该反应的热化学反应方程式: .