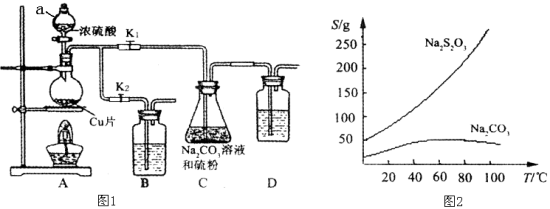
题目内容
【题目】常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
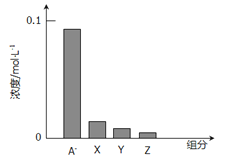
A. A可能表示Na+ B. A可能表示乙酸分子
C. 若图中A表示CH3COO-,可以证明乙酸是弱酸 D. 该混合溶液中:c(A)+c(Y)=c(X)+c(Z)
【答案】C
【解析】乙酸和NaOH溶液等体积、等浓度混合,CH3COOH+NaOH=CH3COONa+H2O,在溶液中存在CH3COO-+H2O![]() CH3COOH+OH-,所得溶液中CH3COO-浓度小于0.1mol/L,但水解程度较小,因此A为CH3COO-,CH3COONa 溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(CH3COO-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),即X表示OH-,Y表示CH3COOH,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA)。A.c(Na+)=0.1mol/L,故A错误;B.A为CH3COO-,不可能是乙酸分子,故B错误;C. 乙酸是弱酸,乙酸钠水解,使得c(CH3COO-)<0.1mol/L,故C正确;D.根据上述分析,A为CH3COO-,X表示OH-,Y表示CH3COOH,Z表示H+,c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),因此c(CH3COO-)+c(CH3COOH)>c(OH-)+c(H+),故D错误;故选C。
CH3COOH+OH-,所得溶液中CH3COO-浓度小于0.1mol/L,但水解程度较小,因此A为CH3COO-,CH3COONa 溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(CH3COO-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),即X表示OH-,Y表示CH3COOH,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA)。A.c(Na+)=0.1mol/L,故A错误;B.A为CH3COO-,不可能是乙酸分子,故B错误;C. 乙酸是弱酸,乙酸钠水解,使得c(CH3COO-)<0.1mol/L,故C正确;D.根据上述分析,A为CH3COO-,X表示OH-,Y表示CH3COOH,Z表示H+,c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),因此c(CH3COO-)+c(CH3COOH)>c(OH-)+c(H+),故D错误;故选C。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目