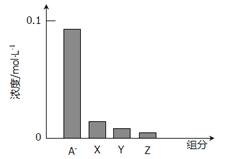
题目内容
【题目】下列叙述正确的是( )
A. 常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B. 在0.1 molL﹣1 CH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C. 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
D. 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
【答案】A
【解析】A.10ml0.02mol/L的HCl溶液与10ml0.02mol/L的Ba(OH)2溶液充分混合后,若混合后溶液体积为20ml,反应后的溶液中c(OH-)=![]() =0.01mol/L,c(H+)=
=0.01mol/L,c(H+)=![]() mol/L=1×10-12mol/L,PH=-lg1×10-12=12,故A正确;B.Ag2S与AgCl的构型不同,无法判断sp(Ag2S)< Ksp(AgCl),故B错误;C.在0.1 molL-1 CH3COONa溶液中,存在质子守恒,即水电离出的氢离子等于水电离的氢氧根离子,则c(OH-)=c(CH3COOH)+c(H+),另外钠离子浓度为0.1 molL-1 ,如果溶液的体积为1L,则n(OH﹣)+0.1mol=n(CH3COOH)+n(H+)+n(Na+),故C错误;D.HC2O4-既能电离又能水解:HC2O4-C2O42-+H+,电离显酸性;HC2O4-+H2OH2C2O4+OH-,水解显碱性,而现在溶液pH=4,显酸性,故HC2O4-的电离程度大于其水解程度,故有c(C2O42-)>c(H2C2O4),故D错误;故选A。
mol/L=1×10-12mol/L,PH=-lg1×10-12=12,故A正确;B.Ag2S与AgCl的构型不同,无法判断sp(Ag2S)< Ksp(AgCl),故B错误;C.在0.1 molL-1 CH3COONa溶液中,存在质子守恒,即水电离出的氢离子等于水电离的氢氧根离子,则c(OH-)=c(CH3COOH)+c(H+),另外钠离子浓度为0.1 molL-1 ,如果溶液的体积为1L,则n(OH﹣)+0.1mol=n(CH3COOH)+n(H+)+n(Na+),故C错误;D.HC2O4-既能电离又能水解:HC2O4-C2O42-+H+,电离显酸性;HC2O4-+H2OH2C2O4+OH-,水解显碱性,而现在溶液pH=4,显酸性,故HC2O4-的电离程度大于其水解程度,故有c(C2O42-)>c(H2C2O4),故D错误;故选A。

【题目】下列表格中各项都正确的一组是( )
类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
A | 明矾 | 食盐 | 石墨 | 醋酸 |
B | 纯碱 | CaCO3 | NH3H2O | Fe |
C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
D | KOH | CuSO4 | Na2SO4 | NaClO |
A.A
B.B
C.C
D.D