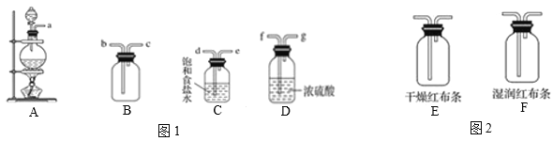
题目内容
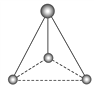
【题目】三氯化氮(NCl3)常温下是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3说法中正确的是( )
A. 分子中N—Cl键是非极性键 B. 分子中不存在孤对电子
C. 它的沸点比PCl3沸点低 D. 因N—Cl键键能大,所以NCl3的沸点高
【答案】C
【解析】A、NCl3分子中存在N-Cl极性键,分子呈三角锥形,分子结构不对称,为极性分子,选项A错误;B、NCl3分子中中心原子N和氯原子间形成三个![]() 极性键,N原子的周围仍然存在一对孤对电子,选项B错误;C、共价化合物的熔沸点是由分子间作用力决定的,而分子间作用力的大小又由相对分子质量决定,所以NCl3的熔沸点比PCl3沸点低,选项C正确;选项D错误。答案选C。
极性键,N原子的周围仍然存在一对孤对电子,选项B错误;C、共价化合物的熔沸点是由分子间作用力决定的,而分子间作用力的大小又由相对分子质量决定,所以NCl3的熔沸点比PCl3沸点低,选项C正确;选项D错误。答案选C。

练习册系列答案
相关题目