题目内容
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1= +180.5 kJ/mol
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
2C(s)+O2(g)===2CO(g) ΔH3=-221 kJ/mol
若某反应的平衡常数表达式为K=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],则此反应的热化学方程式为:_____________。
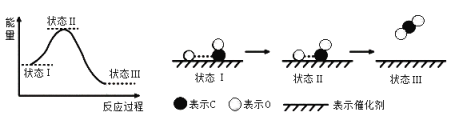
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________。2~5 min内用NO2表示的该反应的平均反应速率为________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3
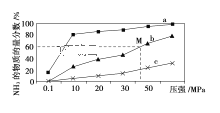
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
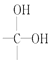
(5)常温下,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的电离平衡常数值_______________。(已知:N2H4+H+![]() N2H5+的K=8.7×107 Kw=1.0×10-14)
N2H5+的K=8.7×107 Kw=1.0×10-14)
【答案】2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1 7∶4(或1.75∶1) 0.22 mol·L-1·min-1 b k正/k逆 200 ℃ 75% 8.7×10-7
【解析】
根据题意可知,本题考查化学反应速率、化学平衡,运用化学反应速率之比等于化学计量数之比,勒夏特列原理分析。
(1)若某反应的平衡常数表达式为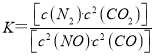 ,发生的反应为2NO(g)+2CO(g)
,发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H,根据盖斯定律,△H=2△H2-△H2-△H1=-746.5kJ/mol
N2(g)+2CO2(g)△H,根据盖斯定律,△H=2△H2-△H2-△H1=-746.5kJ/mol
故答案为:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1;
(2)①相同条件下,气体的物质的量之比等于其压强之比:
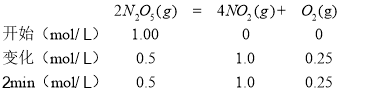
反应前后气体的压强之比等于其物质的量之比,所以p1∶p0=(0.5+1.0+0.25)mol:1.00mol=1.75:1, 2~5 min内,![]() ,根据同一时间段内各物质的反应速率之比等于其计量数之比得,NO2表示的该反应的平均反应速率为v(NO2)=2v(N2O5)=0.22 mol/(L·min),
,根据同一时间段内各物质的反应速率之比等于其计量数之比得,NO2表示的该反应的平均反应速率为v(NO2)=2v(N2O5)=0.22 mol/(L·min),
故答案为:7∶4(或1.75∶1) ;0.22 mol·L-1·min-1;
②a. NO2和O2的浓度比始终都不变,不能确定反应是否达到化学平衡状态,故A错误;
b.该反应为气体体积增大的反应,压强为变量,容器中压强不再变化,说明各组反应的浓度不再变化,反应已达到化学平衡状态,故B正确;
c. v正(NO2)=2v逆(N2O5)才表明达到化学平衡状态,2v正(NO2)=v逆(N2O5)时该反应没有达到平衡状态,故C错误;
d.该反应前后都是气体,气体总质量、气体体积为定值,则密度为定值,不能根据密度判断平衡状态,故D错误。
故答案为:b;
(3)N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) △H=+24.4 kJ·mol-1,
2NO2(g) △H=+24.4 kJ·mol-1,
,上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),
其中k逆、k正为速率常数,则![]() 。
。
故答案为:![]() ;
;
(4)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200 ℃;
故答案为:200 ℃;
②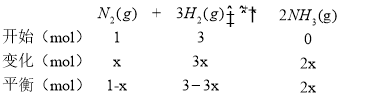 根据题意,M点时:
根据题意,M点时:![]() ,解得x=
,解得x=![]() ,则H2的转化率为
,则H2的转化率为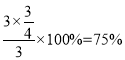 ,
,
故答案为:75%;
(5) 由已知条件可知联氨第一步电离反应的电离平衡常数值Ka=K·Kw=8.7×10-7,
故答案为:8.7×10

【题目】元素周期律(表)是认识元素化合物性质的重要理论。
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是___________________(用“>”“=”或“<”)。
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2_____ Ba (OH)2(填“>”或“<”)。
②用原子结构的观点解释锶的化学性质与钡差异的原因:______________________________
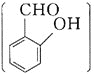
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
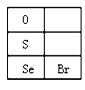
①Se在元素周期表中的位置是_______________。
②H2Se的电子式是______________。
③Cl、Se、Br的非金属性强弱的顺序是__________________;能证明上述强弱关系的事实是____________________________(写出一条即可)。
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
编号 | 性质推测 | 化学方程式 |
1 | 氧化性 | SeO2+2SO2+2H2O=Se+2H2SO4 |
2 | ____________ | ______________ |
3 | ___________ | ____________ |