题目内容
【题目】25℃时,Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8、Ksp(AgCl)=4.0×10-10、Ksp(AgBr)=5.0×10-13。下列说法正确的是
A. 由电离常数分析,CH3COOH溶液的pH一定比HClO溶液的pH小
B. 物质的量浓度相等的CH3COONa和NaClO混合溶液中,各离子浓度大小关系为:
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH)>c(H+)
C. 25℃时,反应AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=800
AgBr(s)+Cl-(aq)的平衡常数K=800
D. 物质的量浓度相等的NaClO溶液和CH3COONa溶液相比较,两者离子的总浓度相等
【答案】C
【解析】A. 溶液的pH不仅与酸的强弱有关,还与浓度有关,故A错误;B. 物质的量浓度相等的CH3COONa和NaClO混合溶液中醋酸钠的水解程度小于次氯酸钠,各离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH)>c(H+),故B错误;C. 25℃时,反应 AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K=
AgBr(s)+Cl-(aq)的平衡常数K= =
= =800,故C正确;D. NaClO溶液水解程度大,溶液中存在c(Na+)+c(H+)=c(OH-)+c(ClO-),CH3COONa溶液水解程度小,溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于次氯酸钠溶液中c(H+)小于醋酸钠溶液中的c(H+),因此离子的总浓度小,故D错误;故选C。
=800,故C正确;D. NaClO溶液水解程度大,溶液中存在c(Na+)+c(H+)=c(OH-)+c(ClO-),CH3COONa溶液水解程度小,溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于次氯酸钠溶液中c(H+)小于醋酸钠溶液中的c(H+),因此离子的总浓度小,故D错误;故选C。

【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
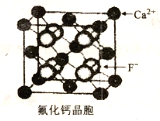
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。
【题目】以菱镁矿(主要成分为MgCO3、含少量FeCO3、SiO2)制备高纯氧化镁的流程如下图所示:

己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如下表:
指示剂 | 酚酞 | 甲基酸 |
变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀时pH | 1.1 | 5.9 | 8.4 |
沉淀完全时pH | 3.7 | 9.6 | 10.2 |
溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(1)操作II和III中涉及的分离方法分别是____________、_______________。
(2)残渣I的主要成分是____________,加入H2O2的过程中可观察到的现象是___________,其中发生的离子反应方程式是_________________________。
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收。煅烧时发生反应的化学方程式是_____________。
(4)采用滴定法测定溶液II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失。实验中应选取_______________指示剂,加入氨水是为了沉淀溶液II中的___________离子,若终点时该离子浓度=1.0×10-5mol·L-1,则溶液III的pH=_____________(己知:lg2=0.3)。


